So reagiert das Immunsystem auf Viren wie Sars-CoV-2
Neue Fragen und Antworten rund um das Coronavirus und die Immunabwehr
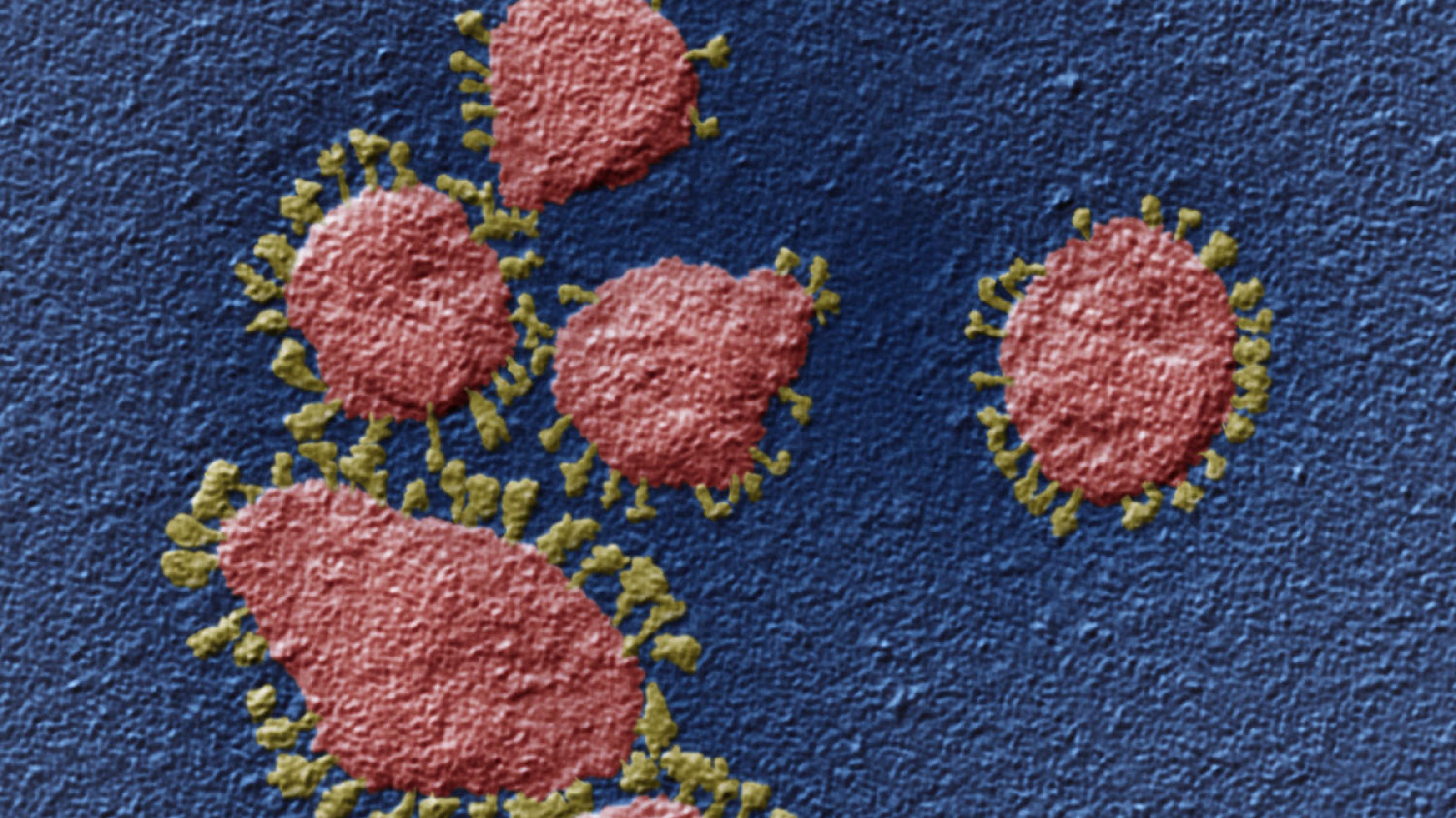
Das Virus ist da und das Leben gerät aus seinem gewohnten Takt. Unser Immunsystem ist mit faszinierenden Fähigkeiten ausgestattet und schützt uns fast immer vor Krankheitserregern und Tumorzellen. Doch angesichts von Sars-CoV-2 kann auch dieses ausgeklügelte Schutzsystem – zumindest bei manchen Menschen – aus der Balance geraten.
Im ersten Teil meiner TAKTVOLL-Serie zum Immunsystem lesen Sie Antworten auf diese Fragen:
Kann man sein Immunsystem stärken, damit es eine Virusinfektion besser abwehren kann?
Hier im zweiten Teil geht es weiter mit dieser Fragen:
Warum werden jetzt Tuberkulose-Impfstoffe getestet, um das Immunsystem bei der Abwehr des neuen Coronavirus zu unterstützen?
Was hat die Immunabwehr damit zu tun, dass überwiegend ältere Menschen so schwer an COVID-19 erkranken?
Kann eine Plasmaspende von Menschen, die eine Infektion mit dem neuen Coronavirus überstanden haben, den schwerkranken COVID-19-Patienten helfen?
Warum werden jetzt Tuberkulose-Impfstoffe getestet, um das Immunsystem bei der Abwehr des neuen Coronavirus zu unterstützen?
Gerade gehen Berichte über eine ungewöhnliche medizinische Maßnahme in der Coronakrise durch die Medien: Ab der nächsten Woche (Ende März/Anfang April) soll in den Niederlanden das medizinische Personal in acht Krankenhäusern gegen Tuberkulose geimpft werden. Ähnliche Studien sind in Deutschland, England und Australien geplant. Was hat die Tuberkulose-Impfung mit dem neuen Sars-CoV-2 zu tun?
Auf den ersten Blick erst einmal gar nichts. Die Tuberkulose wird durch Bakterien verursacht und ist weltweit noch immer eine der häufigsten Todesursachen. Rund 1,3 Millionen Mensch sterben jährlich daran. Der vor knapp 100 Jahren von den französischen Ärzten Albert Calmette und Camille Guérin entwickelte Lebendimpfstoff enthält abgeschwächte Bakterien (Mycobacterium bovis), die eng mit dem Verursacher der Tuberkulose beim Menschen verwandt sind (Mycobacterium tuberculosis). Meist werden bereits Neugeborene geimpft. Die BCG-Impfung (von Bacillus Calmette-Guérin) ist nicht perfekt, kann aber etwa 60% der TB-Infektionen verhindern.
Offenbar kann dieser Impfstoff aber noch mehr. Die abgeschwächten Impfbakterien versetzen die Immunabwehr in eine Art erhöhte Alarmbereitschaft, so dass Geimpfte nicht nur weniger anfällig für die Tuberkulose werden, sondern auch gegenüber anderen Krankheitserregern, Pilzen, Bakterien, Viren. „Die Impfung mit Lebendviren löst eine unspezifische Aktivierung des Immunsystems aus, die die Geimpften auch vor anderen Infektionskrankheiten schützen“, schreibt das Deutsche Ärzteblatt.
Noch ist kein Impfstoff gegen Sars-CoV-2 verfügbar. Erstaunlich, dass man sich von einem immerhin schon 100 Jahre alten Impfstoff nun Hilfe in der Übergangszeit erhofft. Das Interesse an dem unkonventionellen Versuch ist laut der beteiligten Forscher groß. Man hofft, dass die BCG-Impfung COVID-19-Verläufe abschwächt. Von den 1000 Mitarbeitern in den Niederlanden erhalten 500 den Impfstoff, 500 ein Placebo, um zu testen, ob in der BCG-Gruppe tatsächlich weniger Männer und Frauen (schwer) erkranken.
(*)
Schon seit ungefähr 100 Jahren gibt es Hinweise dafür, dass Impfstoffe über ihre eigentliches Ziel hinaus auch die Widerstandskraft gegenüber anderen Krankheitserregern verändern können. So beobachtete der schwedische Arzt Carl Näslund in den 1920er Jahren, dass Kinder in seinem Bezirk weitaus häufiger ihren ersten Geburtstag erlebten, wenn sie eine BCG-Impfung erhalten hatten. Da die Tuberkulose jedoch eher eine Todesursache älterer Kinder war, vermutete Näslund, der BCG-Impfstoff erzeuge zusätzlich zu dem erwünschten Effekt noch eine nicht-spezifische Immunität.
Ende der 1970er Jahre bemerkte der dänische Anthropologe Peter Aaby nach Einführung der Masernimpfung (ebenfalls ein Lebendimpfstoff) in einigen Regionen des westafrikanischen Guinea-Bissau ein Absinken der Kindersterblichkeit um ein Drittel. Da die Masern nur für bis 15% der Todesfälle dort verantwortlich waren, vermutete Aaby, der Impfstoff schütze vor mehr als nur vor einer Maserninfektion.
Die Idee der unspezifischen Wirkung von Impfstoffen ist umstritten. Einige experimentelle Daten stützen die sperrige (und auch heikle) Hypothese jedoch, die WHO hält den Ansatz inzwischen für plausibel. BCG-geimpfte Mäuse etwa zeigen sich im Labor robuster gegenüber Infektionen der Atemwege durch z. B. Grippeviren. Forscher der Universität Nijmegen berichteten vor zwei Jahren, dass sich bei gesunden Studienteilnehmern die abgeschwächten Impfviren nach der Impfung gegen Gelbfieber in geringerem Umfang vermehrten, wenn die Probanden zuvor gegen Tuberkulose geimpft worden waren. Offenbar konnten sich die Gelbfieber-Impfviren nicht so sehr im Körper ausbreiten, weil sich die Zellen der angeborenen Immunabwehr, insbesondere die Monozyten, durch die vorherige BCG-Impfung in einem „aktivierten“ – die Forscher nennen es „immuntrainierten“ – Zustand, befanden.
Die abgeschwächten BCG-Impfviren „halten“ sich nach Angaben der niederländischen Forscher nach der Impfung über mehrere Monate unter der Haut. Sie könnten daher über längere Zeit die angeborene Immunabwehr stimulieren. Einige regulatorische Genabschnitte der Immunzellen werden durch das „Impfstoff-Immuntraining“ epigenetisch offenbar so verändert, dass insbesondere die Monozyten Krankheitserreger schneller erkennen und die Immunabwehr insgesamt rascher in Gang kommen könnte.
BCG sei natürlich kein Impfstoff gegen das neue Coronavirus, betont Christine Stabell Benn von der University of Southern Denmark. Die dänische Ärztin beschäftigt sich seit langem mit den unspezifischen Wirkungen von Impfstoffen. Viele, die mit BCG geimpft werden, würden sich wahrscheinlich trotzdem mit Corona infizieren, schreibt mir die dänische Ärztin in einer Mail. „Aber ich denke, es gibt eine gute Chance, dass BCG die Anzahl der Infizierten verringern und die Schwere der Coronainfektion reduzieren kann“, so Christine Stabell Benn weiter. Der nebenwirkungsarme BCG-Impfstoff sei altbekannt. Ihn in der aktuellen Lage zu testen, sei lohnenswert.
(**)
*(Auch in Deutschland wird es Tests mit medizinischem Personal und älteren Menschen geben. Hier wird allerdings nicht die altbekannte BCG-Impfung verwendet werden, sondern der darauf basierende neue, von Forschern des Berliner MPI für Infektionsbiologie entwickelte Impfstoff VPM1002. Diese Vakzine soll noch wirksamer und sicherer sein, als der alte BCG-Impfstoff.)
**(Vor sechs Jahren habe ich schon einmal ein ausführliches Interview mit Christine Stabell Benn geführt. Wer sich für das Thema „unspezifische Impfwirkung“ interessiert, kann das Interview hier lesen.)
Was hat die Immunabwehr damit zu tun, dass überwiegend ältere Menschen so schwer an COVID-19 erkranken?
Das Immunsystem älterer Menschen ist meist nicht mehr so leistungsfähig, wie das der Jüngeren. Für die altersbedingte Abwehrschwäche (Immunseneszenz) gibt es mehrere Gründe. Die Aktivität der angeborenen Immunabwehr, die sofort nach einer Infektion einsetzt, lässt nach. Beispielsweise sinkt die Anzahl und Aktivität von Fresszellen, weniger Erreger werden von ihnen umschlossen und unschädlich gemacht. Natürliche Killerzellen sind meist weniger aggressiv gegenüber Eindringlingen und schütten weniger Immunbotenstoffe aus.
Im Alter ist außerdem die Thymusdrüse nicht mehr so aktiv. Hier reift eine Gruppe von Immunzellen, die T-Zellen, heran, die besonders für die Abwehr von Viren wichtig sind. Auch die Produktion anderer Immunzellen lässt nach. Sie werden im Knochenmark tagtäglich in großer Zahl (normalerweise über 100 Milliarden) aus Stammzellen gebildet.
Je älter wir werden, desto mehr Entzündungsstoffe haben wir im Blut. Dieses als „Inflammaging“ bekannte Phänomen erschwert unter anderem die saubere Absprache der Immunzellen untereinander, die über immunologische Botenstoffe kommunizieren. Dadurch kann das Immunsystem älterer Menschen schneller aus dem Gleichgewicht geraten. Wie hoch der Spiegel an Entzündungsstoffen im Körper ist, hängt auch vom Lebensstil ab. Wer sich viel bewegt, hat meist niedrigere Blutwerte.
Ein älterer Mensch hat eine lange Infektionsgeschichte, also bereits eine Fülle an Begegnungen mit Krankheitserregern hinter sich. „Über die Jahre hat das gealterte Immunsystem viele Erinnerungen angesammelt, wodurch es auf neue Herausforderungen manchmal nicht mehr flexibel reagieren kann“, erklärt der Immunologe Georg Holländer von der Universität Basel/Oxford. Man könne diesen Zustand mit einer Bibliothek vergleichen, die zwar immer noch die gleiche Anzahl an Büchern vorhält wie vor 50 Jahren.
Etwas Wesentliches hat sich jedoch geändert: In den Regalen stehen Dutzende Kopien gleicher Exemplare. „Wenn nun jemand ein neues Buch ausleihen will, findet er es nicht, weil es wegen der begrenzten Kapazitäten gar nicht in den Regalen steht“, erklärt Holländer. Auf die Immunabwehr bezogen heißt das: das Repertoire an verschiedenen Antikörpern und Immunzellen, die zum Beispiel gegen neue Viren oder von neuen Viren infizierte Zellen vorgehen können, sinkt mit zunehmendem Alter.
Die Infektanfälligkeit erhöht sich bei Älteren häufig auch durch einen Mangel an Mikronährstoffen, Vitaminen und Mineralstoffen (Zink, Selen, Folsäure, Vitamin A, B6, C, D, E). Diese Unterversorgung kann die Folge einer einseitigen Ernährung oder einer verringerten Aufnahmefähigkeit für Nährstoffe im Verdauungstrakt sein.
Frauen und Männer über 65 Jahre sterben viel häufiger an einer Lungenentzündung als jüngere Menschen. 9 von 10 zusätzlichen Todesfällen treten während einer klassischen Grippesaison in dieser Altersgruppe auf (4). Nach Angaben des Robert-Koch-Instituts sind zurzeit (Stand 30.3.20) in Deutschland 87% der an COVID-19 Verstorbenen älter als 70 Jahre.
Kann eine Plasmaspende von Menschen, die eine Infektion mit dem neuen Coronavirus überstanden haben, den schwerkranken COVID-19-Patienten helfen?
Die drei Männer und zwei Frauen im Alter von 36 bis 65 Jahren waren schwer an COVID-19 erkrankt. Alle fünf litten an einem akuten Lungenversagen, verursacht durch eine schwere, fortschreitende Lungenentzündung. Obwohl die Patienten antivirale Medikamente erhielten (die für die Behandlung von HIV zugelassen sind), blieb die Menge an Sars-CoV-2 in den Atemwegen anhaltend hoch. Wegen ihres kritischen Zustandes behandelten die chinesischen Ärzte in Shenzhen sie mit einem „Heilserum“ von Patienten, die eine COVID-19-Erkrankung überstanden hatten und seit mindesten 10 Tagen ohne Symptome gewesen waren.
Im Blut der Spender befanden sich hohe Konzentrationen an neutralisierenden Antikörpern gegen Sars-CoV-2. Von jedem Spender wurden per „Blutwäsche“ je 400 Milliliter Plasma gewonnen und noch am selben Tag per Transfusion übertragen. Das Blutplasma ist der Teil des Blutes, der keine Blutkörperchen, dafür aber alle löslichen Bestandteile enthält, also auch die Antikörper.
Die Körpertemperatur der Schwerkranken normalisierte sich innerhalb von drei Tagen nach der Spende. Das Ausmaß der Organschädigungen und die Sauerstoffversorgung verbesserten sich innerhalb von 12 Tagen. Gleichzeitig waren immer weniger Viren in den Atemwegen nachweisbar, die Menge an Antikörpern gegen Sars-CoV-2 im Blut stieg dagegen deutlich an. Drei der fünf Patienten konnten inzwischen entlassen werden, zwei andere befinden sich gut einen Monat nach der Transfusion in einem stabilen Zustand.
Das Studiendesign und die geringe Größe der Studiengruppe ließen jedoch noch keine definitive Aussage über die Wirksamkeit dieser Behandlung zu, schränken die chinesischen Forscher um Chenguang Shen in ihrem Bericht ein, der jetzt im Medizinerjournal JAMA erschien. Erst eine Überprüfung in größeren klinischen Studien könne Sicherheit bringen. Ob es die Plasmaspende war, die den fünf Patienten tatsächlich half, ist also schwer zu sagen. Keiner weiß, ob es ihnen nicht auch ohne diese Therapie im Laufe der Zeit besser gegangen wäre. Denn über eine Kontrollgruppe, die im Vergleich keine Plasmaspende erhielt, berichten die Wissenschaftler aus Shenzhen jetzt nicht.
Ärzte aus aller Welt scheinen sich trotz der unklaren Aussichten aktuell in der Übergangsphase bis ein Impfstoff verfügbar ist, an diesen Therapie-Strohhalm zu klammern. Der Vorteil des Heilserums: nach einem Screening der Spender auf potenziell gefährliche Krankheitserreger, kann das Plasma verwendet werden. Es braucht keine langwierigen Studien und Medikamententests. Krankenhäuser in New York zum Beispiel rufen gerade Menschen zur Blutspende auf, die von COVID-19 betroffen und wieder gesund sind. Auch in Deutschland bitten Axel Haverich und Rainer Blasczyk von der Medizinische Hochschule Hannover, Genesene um eine Plasmaspende.
Ihr Kollege Reinhold E. Schmidt, Direktor der Klinik für Immunologie und Rheumatologie an der Medizinischen Hochschule Hannover, ist skeptisch. „Eine Antikörper-Gabe macht nur Sinn, wenn sie vor oder in einer ganz frühen Phase einer Infektion erfolgt“, sagt Schmidt. Warum der Ansatz der passiven Immunisierung bei COVID-19 ungeeignet sei, erkläre sich aus dem Krankheitsgeschehen. „Was die Betroffenen im Verlauf einer Infektion so krank macht, ist eine Überreaktion des Immunsystems, das Virus spielt zu diesem Zeitpunkt keine Rolle mehr“, sagt Schmidt. Daher könnten gespendete Antikörper, die Sars-CoV-2 blockieren, den Patienten in der späten Krankheitsphase nicht mehr nützen.
Dieses Problem sieht auch Rainer Blasczyk. Zwar sei die Plasmaspende für schwerkranke Patienten geplant. Er könne sich aber auch vorstellen, leichter erkrankte Personen damit zu versorgen, damit sich ihr Krankheitszustand gar nicht erst nicht verschlechtere.
Die Hoffnungen, die mit einer passiven Immunisierung verbunden sind, gründen sich auf die historischen Anfänge. Als Erfinder gilt der deutsche Immunologe Emil von Behring. 1894 begann Behring zusammen mit der Firma Hoechst ein Diphtherie-Serum in Pferden herzustellen. Die Tiere wurden mit dem Toxin geimpft, das die Erreger der Diphtherie, das Bakterium Corynebacterium diphtheriae herstellen. Einige Zeit später befand sich im Blut der Tiere ein Stoff, Ehrlich nannte ihn das „Anti-Toxin“, das die krankmachende Wirkung des Diphtherie-Erregers abschwächen konnte. Anfang der 1880er Jahre starben allein in Preußen jährlich etwa 25.000 Säuglinge und kleine Kinder an der Erkrankung. Schon kurz nach der Einführung der Serumtherapie sank die Sterblichkeit durch Diphtherie auf ein Fünftel.
Die Methode war besonders wirksam, wenn die Kinder das Heilserum frühzeitig erhielten. Etwas später entwickelte Behring, der „Retter der Kinder“, eine ähnliche Strategie für die Behandlung von Wundstarrkrampf (Tetanus).

Wie gut eine passive Immunisierung wirken kann, hängt entscheidend von den Eigenschaften des Krankheitserregers und davon ab, wie der Infizierte und seine Immunabwehr auf die Konfrontation reagiert. Nicht immer ist beispielsweise so wie bei der Diphtherie oder Tetanus, ein von den Bakterien produziertes Toxin für die Krankheitsbeschwerden verantwortlich. Meist resultieren die Symptome aus einem Gemisch der direkt schädigenden Wirkung der Viren oder Bakterien gegenüber den Körperzellen UND Kollateralschaden durch die Aktivität der Immunzellen. Bei der Influenza-Grippe etwas sind die Effekte einer passiven Immunisierung lange nicht so deutlich erkennbar wie bei der Diphtherie. Während der Grippepandemie 1918 erhielten rund 1700 Patienten das Blutserum von Männern und Frauen, die die Grippe überlebt hatten. Was und ob diese Aktion tatsächlich etwas gebracht hat, ist wegen der verwendeten Studienprotokolle heute jedoch nicht mehr gut nachzuvollziehen.
Die Wissenschaftsjournalistin Amy Maximenberichtet im Fachmagazin „Nature“ über wenn auch mäßige Erfolge, die man in jüngster Vergangenheit mit der passiven Immunisierung gemacht habe. Beim SARS-Ausbruch 2002/2003 hatten die Menschen, die mit dem Plasma von Genesenen behandelt worden waren, offenbar eine größere Chance, die Infektion zu überleben, als die Patienten, die kein Heilserum erhalten hatten. Auch bei der Ebola-Epidemie hätte es bescheidene Hinweise für eine Wirksamkeit der passiven Immunisierung gegeben, schreibt Maximen.
Auch Lars Fischer listet für spektrum.de einige Fakten auf, die Hoffnung machen. „Eine Metaanalyse aus dem Jahr 2015 deutet ebenfalls darauf hin, dass solche Übertragungen die Sterblichkeit bei schweren Atemwegsinfektionen reduzieren", schreibt Fischer. Die genannteMetastudie beinhaltet 32 Studien zu SARS und Infektionen mit dem Influenza-Virus. Die Verfasser geben sich nach der Analyse der Studien, die – so ihre Einschätzung – häufig von schlechter Qualität seien, mit einem „könnte“ sehr vorsichtig: die Behandlung mit dem Plasma ist sicher und könnte die Sterblichkeit verringern.