Corona: Warum trifft es manche besonders hart?
Ob man zur Risikogruppe gehört, entscheidet nicht alleine über die Schwere einer Covid-19-Erkrankung. Genetik und Epigenetik reden mit. Diese Erkenntnis wird Vorbeugung und Therapie verbessern.

Neue Studien zeigen: Auch die Molekularbiologie der Betroffenen prägt den Verlauf einer Infektion mit dem neuen Coronavirus. Deshalb sind sogar junge Menschen nicht immer vor einem schweren Verlauf der Infektion geschützt. Und manche Alte und Vorerkrankte entwickeln trotz theoretisch hohem Risiko kaum Symptome.
Dieser Beitrag ist wegen der Dringlichkeit in der Coronakrise kostenlos. Möchten Sie das gesamte Angebot von Erbe&Umwelt lesen sowie das neue Online-Magazin unterstützen, schließen Sie bitte ein E&U-Abonnement oder eine Riff-Abo für alle RiffReporter-Beiträge ab.
Im Angesicht des neuen Coronavirus sind alle Menschen gleich. Das sollte man zumindest meinen. Doch die Realität sieht anders aus. Selbst Menschen gleichen Geschlechts und Alters mit vergleichbaren Vorerkrankungen und ähnlichem Körpergewicht leiden mitunter an einer Covid-19-Infektion sehr unterschiedlich stark. Manche sterben oder kämpfen über Monate mit schweren Folgeschäden. Andere zeigen trotz nachgewiesener Infektion keine oder nur milde Symptome.
Was aber ist das Geheimnis hinter den unterschiedlichen Covid-19-Verläufen? Das war bis vor kurzem unbekannt, doch jetzt häufen sich die Hinweise, dass Unterschiede des Immunsystems sowie die Genetik und die Epigenetik gleichermaßen eine Rolle spielen. Es entscheiden also sowohl der von den Vorfahren geerbte Text der DNA, als auch die nebengenetisch aktive Umgebung des Erbgutmoleküls.
Erfolgreiche Spurensuche in Patientendaten aus Spanien und Italien
Im einen Fall sind es bestimmte Genvarianten, die dafür sorgen, dass die Menschen etwas unterschiedliche Biomoleküle erzeugen und dadurch widerstandsfähiger oder anfälliger sind als andere. Man könnte auch sagen, die Hardware der Zellen unterscheidet sich. Im anderen Fall sind es Unterschiede bei den epigenetischen Strukturen. Diese schenken unseren Zellen ein individuelles Programm. Kleine biochemische Anhängsel, die an oder neben der DNA einer Zelle sitzen, entscheiden wie Dimmer oder Schalter darüber, welche ihrer Gene die Zelle besonders gut benutzen kann und welche nicht.
Das verändert nicht die Art der Biomoleküle – Enzyme, Botenstoffe, Rezeptoren, Bausubstanzen und ähnliches – sondern ihre Häufigkeit und Zusammensetzung in und außerhalb der Zelle. Der Text der DNA wird durch die Epigenetik interpretiert und in Wechselwirkung mit der Umwelt verschieden stark ausgelesen. Um im Bild zu bleiben, ist es in diesem Fall also die jeweilige Software der Zellen, die das Krankheitsrisiko beeinflusst. Und die wurde auch durch die individuelle Vergangenheit der Infizierten geprägt.
Wie wichtig der Text der Gene zu sein scheint, also die Genetik, folgt besonders eindrucksvoll aus den Analysen eines großen europäischen Teams von Genetiker*innen. Die „Severe Covid-19 GWAS Group“ fahndete in Patientendaten aus Spanien und Italien systematisch mit Hilfe einer so genannten genomweiten Assoziationsstudie (GWAS) nach Varianten im Erbgutmolekül DNA, die bei solchen Menschen besonders häufig sind, die schwer an Covid-19 erkranken. Rasch wurde das Team fündig: Eine Gruppe von Genen auf dem Chromosom Nummer drei und ein Teil der DNA, der über unsere Blutgruppen mitentscheidet, sind bei schwer erkrankten Menschen auffällig häufig verändert.
Noch weiß zwar niemand, ob und wie die beteiligten Gene die Krankheit direkt beeinflussen. Es ist auch nicht bekannt, welche Gene der auffälligen DNA-Abschnitte genau betroffen sind. Schließlich handelt es sich bei den Resultaten um bloße, mit Hilfe der Mathematik entdeckte Korrelationen. Eines aber ist sicher: Die Ergebnisse liefern aussichtsreiche Ansatzpunkte für weitere Forschungen. Gut möglich, dass zukünftige Coronavirus-Therapien und Diagnosemethoden an der nun eingekreisten molekularbiologischen Hardware ansetzen werden.
"Dies ist der wichtigste genetische Risikofaktor für schwere SARS-CoV-2-Infektionen und Krankenhausaufenthalte." (Jeanette Erdmann)
Denn die entsprechenden Genvarianten sind definitiv mit unserem Schicksal verknüpft. Entweder verändern sie das Erkrankungsrisiko direkt oder sie weisen indirekt auf andere Risikofaktoren hin. Zumindest bei dem Abschnitt auf dem Chromosom Nummer drei seien die ersten Resultate mittlerweile sogar durch andere Wissenschaftler*innen bestätigt worden, sagte die Lübecker Genetikerin Jeanette Erdmann dem Science Media Center. Es handele sich um den „wichtigsten genetischen Risikofaktor für schwere SARS-CoV-2-Infektionen und Krankenhausaufenthalte“.
Der Leipziger Evolutionsbiologe Hugo Zeberg benennt das Risiko gegenüber spektrum.de noch etwas genauer: „Die Wahrscheinlichkeit, dass Menschen, die diese Genvariante geerbt haben, bei einer Infektion mit dem neuartigen Coronavirus Sars-CoV-2 künstlich beatmet werden müssen, ist etwa dreimal höher.“ Mit seinem Kollegen Svente Pääbo veröffentlichte Zeberg unlängst Hinweise, dass diese genetische Auffälligkeit von Neandertalern kommt. Sie stammt aus einer Zeit, als sich beide Arten miteinander vermischten.
Trotz ihrer offensichtlichen Nachteile in der Coronakrise hat sich die genetische Auffälligkeit also bis heute bei einigen von uns im Laufe der Evolution seit rund 40.000 bis 60.000 Jahren gehalten. Es ist deshalb anzunehmen, dass die Genvariante auch Vorteile mit sich bringt, vermutet der Kieler Molekularbiologe Andre Franke: „Der größte Teil des Neandertaler-Genoms, etwa 95 Prozent in unseren Genomen, " sei im Laufe der Evolution wieder verschwunden. Da die neu entdeckte Corona-Risikogenvariante bis heute geblieben sei, müsse sie „auch eine positive Rolle spielen.“ Eventuell sorge sie für ein besonders aktives Immunsystem. Das ist zwar grundsätzlich gut, kann bei einer Coronainfektion in Kombination mit zusätzlichen Risikofaktoren wie Übergewicht, Herzproblemen oder einem hohen Alter aber auch nachteilig sein.
Die Gene der Neandertaler scheinen Vor- und Nachteile zu haben
Jedoch ist umstritten, ob die entsprechenden Genvarianten tatsächlich aus der DNA der Neandertaler stammen. Jeanette Erdmann fand noch im Sommer die Datenlage angesichts einer Vorabpublikation „viel zu dünn“. Seitdem wurde die Studie allerdings von unabhängigen Expert*innen begutachtet und vom weltweit führenden Fachblatt Nature akzeptiert.
Etwa die Hälfte aller Menschen in Südasien und rund 16 Prozent der Europäer*innen tragen das mutmaßliche Neandertaler-Erbe und mit ihm das genetisch verankerte erhöhte Corona-Risiko der Nature-Studie zufolge in ihrer DNA. Besonders häufig existiere die Varianten bei Menschen aus Bangladesch (63 Prozent). Das passt gut ins Bild. Denn von diesen weiß man tatsächlich bereits, dass sie an Covid-19 oft ernsthafter erkranken als der Durchschnitt.
In einem nächsten Schritt möchten die Forscher*innen nun natürlich herausfinden, wie die neu entdeckten Coronarisiko-Genvarianten die Menschen biologisch beeinflussen. Auf diesem Weg wollen sie dem neuen Virus einige seiner Geheimnisse entreißen. Sie fahnden fieberhaft nach neuen Methoden, um besonders gefährdete Menschen und drohende lebensbedrohliche Verläufe frühzeitig zu erkennen und besser zu behandeln. Es geht um die möglichst lückenlose Aufklärung der Krankheitsmechanismen sowie um deren personalisierte und präzise Bekämpfung.
An diesem Punkt kommt auch die Epigenetik ins Spiel, also die Software der Zellen, die von der Umwelt und der Vergangenheit der Patienten mitgeprägt wurde. Es sind nämlich die nebengenetischen Schalter und Dimmer, mit deren Hilfe die Zellen unseres Körpers auf ihre Umgebung und die Herausforderungen des Lebens reagieren. Anders als die Gene, die nur selten und noch dazu zufällig mutieren, können sich die epigenetischen Strukturen in kurzer Zeit und als Reaktion auf äußere Einflüsse gezielt verändern. Sie helfen Lebewesen bei ihrer biologischen Entwicklung und bei der kurzfristigen Anpassung an schwankende Umweltbedingungen. Das macht sie zu besonders aussichtsreichen Kandidaten für zukünftige Ansätze der Covid-19-Diagnostik und Behandlung.
Coronaviren manipulieren die Epigenetik ihre Wirtszellen
Schon im Jahr 2017 – also lange vor dem Auftreten von SARS-CoV-2 – wiesen die Epidemiolog*innen Alexandra Schäfer und Ralph Baric aus Chapel Hill, USA, in einer Übersichtsarbeit darauf hin, dass Coronaviren wie SARS-CoV-1 oder MERS die Epigenetik ihrer Wirtszellen verändern. Auf diesem Weg scheinen sie befallene Zellen so umzuprogrammieren, dass diese besonders viele neue Viren erzeugen. Dazu nutzen sie das gesamte epigenetische Repertoire: Sie bauen Methylgruppen (CH3) an die DNA an oder entfernen sie, modifizieren die Histon-Proteine, um die sich die DNA mal fest, mal locker aufwickelt, beeinflussen nichtkodierende RNAs, die wiederum regeln, wie effektiv der DNA-Code eines Gens in ein Protein übersetzt wird und verändern die räumliche Lage bestimmter Erbgutabschnitte innerhalb des Zellkerns.
All das lässt die Genetik der Zellen unberührt, verändert aber zutiefst die Menge und Art der Gene, die gerade aktiv sind. Damit manipuliert das Virus die Identität der von ihm befallenen Zellen. Gelingt es Forscher*innen eines Tages, diese epigenetischen Prozesse gezielt zu unterbinden, hätten sie ein potenziell hochwirksames Gegenmittel gegen die Viren in Händen.
Vor allem aber erklärt die Epigenetik zum Teil, warum manche Menschen sehr viel ernsthafter erkranken als andere. Verantwortlich scheinen nebengenetische Unterschiede des Immunsystems der Infizierten zu sein – aber auch die Epigenetik jener Zellen, über die die Viren in den Körper eindringen.
So gibt es Hinweise, dass manche Impfungen – etwa die gegen Tuberkulose gerichtete BCG-Impfung, aber auch eine Polio- oder Masernimpfung – indirekt auch gegen Covid-19 helfen können. Vermutlich trainieren diese Impfungen genauso wie bereits überstandene Infektionen nicht nur das spezifische Immunsystem der Geimpften, das sich zielgenau gegen die vorhandene Art von Erregern richtet. Vielmehr scheinen sie zusätzlich die unspezifische, so genannte angeborene Immunantwort zu fördern.
Impfungen verändern auch das unspezifische Immunsystem
Die Anregung des angeborenen Immunsystems könne in den zuständigen Zellen „eine epigenetische Narbe“ hinterlassen, schreibt der Bonner Immunologe Mihai Netea gemeinsam mit seinem Mailänder Kollegen Alberto Mantovani im angesehenen New England Journal of Medicine. Dabei handele es sich um ein Muster von nebengenetischen Strukturen, die gezielt die Aktivierbarkeit solcher Gene verstärken oder erleichtern, die den Zellen bei der Bekämpfung aller möglichen Arten von Krankheitserregern helfen. Klar, dass auch SARS-CoV-2-Viren einem Menschen mit einer solchen epigenetischen Grundausstattung weniger leicht etwas anhaben dürften als Anderen.
Vor diesem Hintergrund macht es laut Netea und Mantovani durchaus Sinn, dass derzeit in mehreren Studien untersucht wird, ob eine BCG-Impfung gegen Covid-19 helfen könne. Netea selbst ist an zweien dieser Studien beteiligt. Für eine allgemeine Empfehlung sei es dennoch zu früh, geben sich die Autoren vorsichtig. Noch müsse man die endgültigen Resultate abwarten. „Der Einsatz von BCG zur Prophylaxe oder Behandlung von Covid-19 außerhalb einer kontrollierten medizinischen Studie ist nicht zu empfehlen“, lautet das Fazit.
Doch nicht immer ist ein besonders aktives Immunsystem gut für Corona-Patient*innen. Manchmal kommt es als Reaktion auf den Krankheitserreger zu einer übermäßigen Ausschüttung von Zytokinen genannten Botenstoffen, die Entzündungsreaktionen anstoßen. Startet ein solcher Zytokinsturm, leiden eine Menge innerer Organe, und Covid-19 nimmt einen gefährlichen Verlauf. Das Robert Koch-Institut spricht in diesem Fall von der „späten, hyperinflammatorischen Erkrankungsphase“. Das Immunsystem der Patient*innen schießt dann sozusagen über sein Ziel hinaus.
Nicht zuletzt um diese fatale Überreaktion zu bekämpfen erhalten Covid-19-Patient*innen, die zusätzlichen Sauerstoff verabreicht bekommen oder künstlich beatmet werden müssen, häufig das Medikament Dexamethason – so zum Beispiel unlängst auch der US-Präsident Donald Trump. Es simuliert eine allgemeine Stressreaktion, unterdrückt so das Immunsystem und dämpft damit auch den Sturm der Entzündungsboten.
Nun gibt es schlüssige Indizien, dass bei Menschen mit einem hohen Risiko für bedrohliche Covid-19-Verläufe die epigenetische Regulation solcher Gene in eine ungünstige Richtung verändert ist, die die Ausschüttung der Zytokine überwachen. Das hätte zur Folge, dass die Einen sehr viel eher zum Zytokinsturm neigen als die Anderen.
Epigenetik verändert die Zahl der Corona-Andockstellen
Diese Resultate veröffentlichten Amr Savalha von der University of Pittsburgh, USA, und Kolleg*innen im Sommer im Fachblatt Clinical Immunology. In der gleichen Studie finden sich Hinweise auf einen weiteren Weg, wie die Epigenetik bestimmter Körperzellen das individuelle Covid-19-Risiko beeinflusst. Untersucht wurden Menschen, die an der Autoimmunkrankheit Lupus erythematodes leiden und deshalb zur Corona-Risikogruppe gehören. Bei ihnen scheinen besonders wenige der epigenetisch aktiven Methylgruppen an das so genannte ACE2-Gen angelagert zu sein. Diese Besonderheit führt dazu, dass das zugehörige Gen besonders leicht abgelesen werden kann und die entsprechenden Zellen besonders viele der Proteine besitzen, deren Hardware das ACE2-Gen kodiert.
Doch was hat dieses Detail mit dem Covid-19-Risiko und der mutmaßlichen Schwere des Krankheitsverlaufs zu tun? Das ACE2-Gen enthält den Bauplan für den berühmt-berüchtigten gleichnamigen ACE2-Rezeptor. Und das ist exakt jene Struktur, an die die kronenartigen Dornen auf der Oberfläche des Virus passgenau andocken, um anschließend ihr Erbgut in die Zellen einzuschleusen.
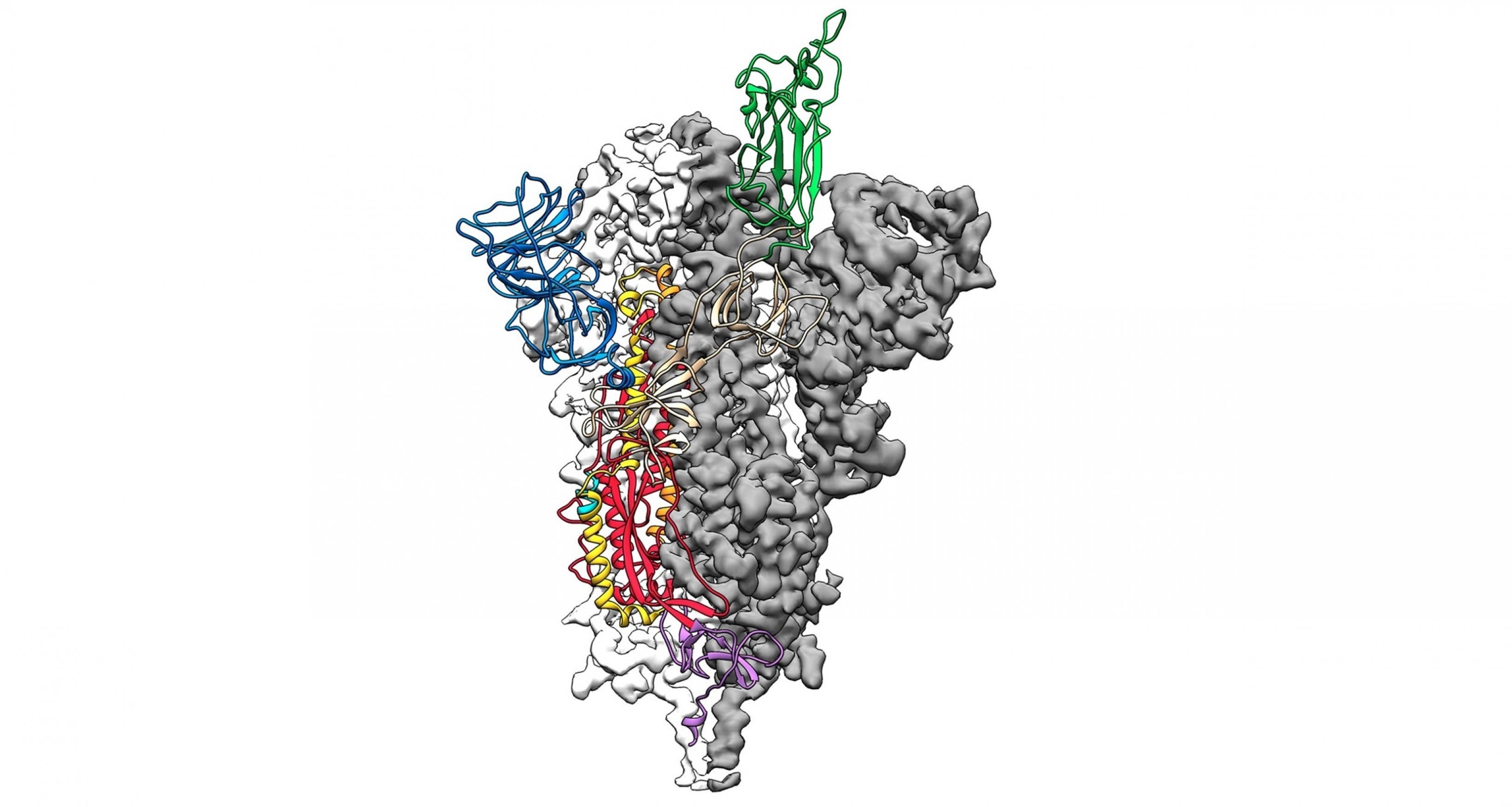
Nur wenn die Viren genügend ACE2-Rezeptoren vorfinden, können sie einen Menschen überhaupt infizieren. Je mehr solcher Andockstellen die Zellen besitzen, desto mehr Viren dringen theoretisch ein, und desto ernsthafter dürfte die Krankheit anschließend verlaufen.
Die epigenetische Regulation dieses wichtigen Proteins gerät derzeit also immer mehr in den Fokus der Wissenschaft. Sie erhofft sich neue Ansätze für die Diagnose, Behandlung und Verlaufsprognose von Covid-19. Einen Test zu entwickeln, der den Grad der Methylierung des ACE2-Gens und eventuell anderer für die Krankheit wichtiger Gene erfasst, sollte jedenfalls ein Kinderspiel sein. Es gibt schon heute eine Reihe anderer epigenetischer Tests, so etwa auf das biologische Alter eines Menschen. Deutlich schwieriger wird es werden, die Aussagekraft eines solchen Tests auch mit der notwendigen Evidenz zu hinterlegen. Ob das gelingt werden zukünftige Studien zeigen.
Viel versprechender Plan: Die Epigenom-Editierung
Noch ein gutes Stück weiter von der Anwendung entfernt ist der Plan von Jamie Hackett vom European Molecular Biology Laboratory (EMBL) in Rom. Er möchte die Epigenetik der ACE2-bewährten Zellen zielgenau manipulieren. Der Molekularbiologe hat mit seiner Gruppe das als Genschere bekanntgewordene und gerade mit dem Nobelpreis für Chemie gewürdigte Verfahren CRISPR/Cas9 so weiterentwickelt, dass man damit nicht die Gene, sondern die nebengenetische Umgebung gezielt verändern kann. Nun möchte er mit diesem Werkzeug das ACE2-Gen von Zellen epigenetisch auf Inaktivierbar stellen. Das würde die Herstellung der Rezeptoren verhindern, somit dem Virus seine Eintrittspforte rauben und die Zellen immun gegen SARS-CoV-2 machen.
In Experimenten mit Mäusen testen die Forscher*innen das Verfahren bereits. Vor dem Einsatz bei Menschen sind allerdings noch sehr viele Fragen zu beantworten und hohe Hürden zu überwinden. So ist noch unklar, welche negativen Folgen ein Mangel an ACE2-Rezeptoren haben könnte. Geringe Mengen des Proteins erhöhten auf Dauer das Risiko für Bluthochdruck, sagt Hackett, aber: „Über kürzere Zeiträume hinweg scheint der Verlust des ACE2-Rezeptors relativ gut toleriert zu werden.“
Das sei einer der Gründe, warum der Molekularbiologe das Gen nur epigenetisch und nicht etwa genetisch modifizieren will. Diese Methode wirke nur für eine gewisse Zeit. Denn die Epigenetik einer Zelle ist – anders als ihre Genetik – an vielen veränderlichen Stellen permanent im Fluss. Man kann sie in Zeiten hohen Risikos anwenden, etwa während einer Pandemie. Und nach einer gewissen Zeit kehren die betroffenen Zellen ganz von alleine zum Ausgangsprogramm zurück – zumindest in der Theorie.
Für die aktuelle Krise wird dieser viel versprechende Ansatz vermutlich zu spät kommen. Aber es ist wahrscheinlich, dass er uns eines mehr oder weniger fernen Tages dennoch gute Dienste erweisen könnte. Fast alle Virologen gehen davon aus, dass die aktuelle Pandemie nicht die letzte ihrer Art sein wird.