Was bringt Remdesivir bei Covid-19?
Warum es manchmal so schwierig ist, den Nutzen neuer Medikamente zu beurteilen
Mehr Informationen zum Projekt „Plan G: Gesundheit verstehen“ finden Sie auf der Spezialseite Besser entscheiden in Sachen Gesundheit.
Eine weltweite Pandemie mit unzähligen Patient:innen.
Eine Krankheit, bei der innerhalb weniger Wochen klar wird, ob Betroffene überleben oder nicht.
Regierungen und Organisationen, die viel Geld in die Forschung pumpen.
Unter diesen Bedingungen sollten Studien doch relativ schnell herausfinden, ob bestimmte Medikamente bei Covid-19 helfen oder nicht.
Zum Beispiel Dexamethason: Eine Erfolgsgeschichte. Kann einigen Menschen mit schwerem Covid-19 das Leben retten.
Zum Beispiel Hydroxychloroquin: Ein Flop. Hilft nicht bei Covid-19.
Zum Beispiel Remdesivir: Nun – es ist kompliziert.
Update 09.09.2022: Die Studienlage hat sich inzwischen verändert. Hier haben wir den zweiten Teil der Geschichte veröffentlicht.
Deutschland, August 2021
Es ist 11.00 Uhr, als Christian Zahn im Gemeinsamen Bundesausschuss (G-BA) in Berlin am 10. August die Anhörung zu Remdesivir eröffnet. Zahn ist stellvertretender Vorsitzender im Unterausschuss Arzneimittel, der sich mit der frühen Nutzenbewertung von neuen Medikamenten befasst.
In diesem Rahmen sind die Anhörungen Routine. Bisher gab es rund 500 solcher Verfahren, die neue Wirkstoffe unter die Lupe nehmen. Die Kernfrage: Nützt das Mittel Patient:innen mehr als die bisherige Standardtherapie? Um die Frage zu beantworten, fasst der Hersteller Studiendaten zusammen. Das Institut für Qualität und Wirtschaftlichkeit (IQWiG) erstellt ein Gutachten. Dazu geben Hersteller, Pharmaverbände und medizinische Fachleute Stellungnahmen ab. Die Anhörung soll offene Fragen und kontroverse Aspekte klären. Anschließend entscheidet der G-BA über den Zusatznutzen, dann beginnen die Verhandlungen über den Preis, den die gesetzlichen Krankenkassen zahlen.
Die Rollen sind dabei in der Regel so verteilt: Der Hersteller kommt zu einem positiven Ergebnis für sein Mittel. Das Gutachten des IQWiG ist eher kritisch. Und die Positionen der medizinischen Fachleute bewegen sich meist irgendwo dazwischen.
An diesem Dienstag ist es aber anders: Das IQWiG kommt fast zu einer ähnlich positiven Einschätzung wie der Hersteller, die medizinischen Fachleute widersprechen mehr oder weniger energisch. Auf den ersten Blick scheint das IQWiG-Gutachten der Empfehlung der Weltgesundheitsorganisation WHO zu widersprechen. Die rät nämlich von Remdesivir ab.
Auf den zweiten Blick stellt sich heraus: Es ist noch viel komplizierter. Das war es mit Remdesivir schon von Anfang an.
Heilmittel dringend gesucht
Die Geschichte von Remdesivir beginnt nicht erst mit Covid-19. Der virushemmende Wirkstoff wurde ursprünglich gegen verschiedene Virus-Erkrankungen entwickelt. Im Tierversuch galt Remdesivir als vielversprechend bei Ebola, scheiterte 2019 jedoch in einer klinischen Studie mit Patient:innen.
Anfang 2020: Das SARS-CoV-2-Virus verbreitet sich weltweit, die Corona-Pandemie nimmt ihren Lauf.
Schnell stellt sich die Frage: Was hilft gegen schwere Verläufe, welche Behandlungen retten Leben? Viele Erkrankte, die mit Atemproblemen ins Krankenhaus müssen, brauchen zusätzlichen Sauerstoff, je nach Bedarf wenig (Low-Flow-Therapie) oder mehr (High-Flow-Therapie). Wer Sauerstoff benötigt, hat nach der WHO-Definition „schweres“ Covid. Wenn Sauerstoff allein nicht ausreicht, bekommen Patient:innen eine Atemunterstützung über eine Maske (nicht-invasive Beatmung). Bei fortschreitender Erkrankung kann eine invasive Beatmung per Beatmungsschlauch oder sogar eine künstliche Lunge (ECMO) notwendig werden.
Zu diesem Zeitpunkt gibt es kein Medikament, das gegen Covid-19 hilft. Eine fieberhafte Suche beginnt. Der Fokus liegt auf bekannten Wirkstoffen wie etwa Remdesivir.
Februar 2020: Die WHO vermeldet weltweit rund 2.200 Todesfälle im Zusammenhang mit Covid-19, die meisten davon in China.
Die Ergebnisse von Labor- und Tierversuchen machen Hoffnung, so dass in Studien bald Covid-19-Patient:innen im Krankenhaus Remdesivir bekommen: Eine kleinere Studie startet im chinesischen Wuhan. Der Hersteller Gilead beginnt kurze Zeit später gemeinsam mit dem US-amerikanischen National Institute of Allergy and Infectious Diseases die Hauptstudie für die Zulassung. Beteiligt sind vor allem US-amerikanische Patient:innen. Später folgen weitere Untersuchungen, die größte davon die internationale SOLIDARITY-Studie der WHO.
Sie alle testen Remdesivir zusätzlich zur damals üblichen Standardbehandlung. Die Wissenschaftler:innen untersuchen, ob mit dem Medikament weniger Menschen sterben. In einigen Studien wird zusätzlich ausgewertet, ob Remdesivir den Krankheitsverlauf positiv beeinflusst, also zum Beispiel den Gesundheitszustand verbessert oder seltener Beatmung notwendig macht. Und dahinter die dringliche Frage: Könnte Remdesivir der Game Changer bei Covid-19 sein, auf den alle warten?
Viel Unsicherheit
Frühjahr 2020: Mehr als 200.000 Covid-19-Tote weltweit.
Die chinesische Studie und die erste Zwischenauswertung der Zulassungsstudie werden publiziert. Die Antwort fällt aber nicht so eindeutig aus wie erhofft:
In der chinesischen Untersuchung zeigen sich keine Vorteile für Remdesivir. Allzu belastbar sind die Ergebnisse aber nicht, weil wegen der raschen Pandemie-Eindämmung in Wuhan nicht so viele Patient:innen wie vorgesehen an der Studie teilgenommen haben.
Die größere US-Studie fällt etwas positiver aus: Es gibt Hinweise, dass sich Patient:innen mit Remdesivir möglicherweise schneller erholen. In einer Zusammenschau der chinesischen und US-amerikanischen Daten spricht möglicherweise einiges für die Behandlung von schwerem Covid-19 mit Remdesivir. Allerdings ist diese Einschätzung unsicher. Andererseits gibt es bislang keine besseren Mittel. Deshalb erteilt die US-amerikanische Zulassungsbehörde FDA Remdesivir im Mai eine Notfallzulassung bei schwerem Covid-19.
Im Juni gibt es einen ersten echten Durchbruch bei der Behandlung von Covid-19 – allerdings mit einem ganz anderen Wirkstoff: In der großen britischen RECOVERY-Studie senkt der Cortison-Wirkstoff Dexamethason die Sterblichkeit bei schwerem Covid-19, wenn die Patient:innen also zusätzlichen Sauerstoff oder sogar Beatmung brauchen.
Juli 2020: Inzwischen verzeichnet die WHO weltweit mehr als 500.000 Covid-19-Tote.
Remdesivir erhält eine bedingte Zulassung durch die europäische Zulassungsbehörde EMA für alle Covid-19-Patient:innen, die zusätzlichen Sauerstoff brauchen. Im August erscheint eine weitere Studie des Herstellers mit Patient:innen aus den USA, Europa und Asien. Sie liefert weitere Daten, kann aber nicht abschließend die offene Frage klären, ob und welchen Patient:innen Remdesivir wie viel nützt. Viel Hoffnung ruht deshalb auf der großen SOLIDARITY-Studie der WHO mit bislang mehr als 5.000 Patient:innen auf der ganzen Welt.
Der SOLIDARITY-Schock
Oktober 2020: Global zählt die WHO mehr als eine Million Covid-19-Tote.
Die ersten SOLIDARITY-Ergebnisse werden veröffentlicht. Das Ergebnis ist jedoch ernüchternd: Ein deutlicher Nutzen von Remdesivir gegenüber der Standardtherapie lässt sich nicht nachweisen. Weder ist es statistisch zweifelsfrei klar, dass das Mittel Leben rettet, noch dass damit Behandelte seltener beatmet oder kürzer im Krankenhaus behandelt werden müssen.
Etwas positiver ist der Abschlussbericht der Zulassungstudie, die ebenfalls im Oktober erscheint. Danach erholen sich Patient:innen mit Remdesivir im Mittel etwa fünf Tage schneller als ohne. Ob Remdesivir die Sterblichkeit senkt, ist in der Gesamtauswertung jedoch nach wie vor nicht eindeutig belegt.
Was bringt Remdesivir, wenn man alle diese teils widersprüchlichen Daten aus den wesentlichen Studien zusammenfasst? Das beschäftigt zunächst die Zulassungsbehörden.
Was FDA und EMA sagen
Die FDA stützt sich in ihrer Bewertung vor allem auf Studien mit US-amerikanischen Patient:innen. Weil sich darin eine schnellere Erholung zeigt, bekommt Remdesivir die vollständige Zulassung für alle Covid-19-Patienten im Krankenhaus. Die Gutachter diskutieren kurz die Frage, warum die SOLIDARITY-Studie zu einem anderen Ergebnis kommt. Für sie die plausibelste Begründung: Die Studien waren unterschiedlich angelegt und die Gesundheitsversorgung unterscheidet sich in den einzelnen Ländern erheblich. Gleichzeitig macht das FDA-Gutachten aber auch klar: In der Zusammenschau aller Daten senkt Remdesivir die Sterblichkeit wahrscheinlich nicht oder allerhöchstens so wenig, dass es keinen echten Unterschied macht.
Dezember 2020: Die WHO meldet rund 1,5 Millionen Covid-19-Todesfälle. Die ersten Corona-Impfstoffe erhalten eine Zulassung, die Impfkampagnen starten.
Die EMA analysiert in ihrem Gutachten die Daten der Remdesivir-Zulassungsstudie noch etwas kleinteiliger. Danach nützt das Mittel beatmeten Patient:innen vermutlich nicht – weder erholen sie sich schneller noch sinkt die Sterblichkeit. Unklar sind die Vorteile bei nicht-invasiver Beatmung oder bei High-Flow-Therapie. Bei Low-Flow-Therapie scheinen sich Patient:innen aber mit Remdesivir tatsächlich einige Tage schneller zu erholen. Auch in der SOLIDARITY-Studie finden die Gutachter:innen der EMA vorsichtige Hinweise, dass kritisch kranke Covid-19-Patient:innen nicht profitieren, andere möglicherweise schon.
Die FDA hatte diese Unterschiede zwar auch in ihrem Gutachten vermerkt, aber nicht für aussagekräftig genug gehalten. Die EMA sieht das anders und schränkt die Zulassung von Remdesivir deutlich ein: Bei invasiver Beatmung oder gar ECMO ist das Mittel seit Dezember 2020 in der EU nicht mehr zugelassen.
In den USA und in der EU umfasst die Zulassung Jugendliche und Erwachsene, in den USA hat Remdesivir auch eine Notzulassung für Kinder.
Nützt Remdesivir bestimmten Patient:innen?
August 2021: Inzwischen sind es mehr als vier Millionen Corona-Tote weltweit, mehr als vier Milliarden Dosen verschiedener Covid-19-Impfstoffe sind verimpft.
Ob Remdesivir einigen Patientengruppen mehr nützt als anderen, ist immer noch umstritten und beschäftigt auch die Anhörungsrunde in Berlin.
Die Diskussion in der Anhörung wird lebhaft. Schließlich hängt von der Antwort auf die Frage nach dem Zusatznutzen von Remdesivir einiges ab: Sie ist nicht nur eine Hilfe für Ärzt:innen bei der Entscheidung, wie sie Patient:innen mit Covid-19 behandeln. Sondern sie beeinflusst auch, welchen Preis der Hersteller mit den gesetzlichen Krankenkassen verhandeln kann. Und der ist nach den Vorstellungen des Herstellers beträchtlich: Das Mittel kostet pro Patient:in je nach Dauer der Behandlung zwischen 3.000 und 6.000 Euro.
Die frühe Nutzenbewertung ist auf die Situation in Deutschland zugeschnitten. Deshalb geht es nur um die Patientengruppen, für die ein Mittel tatsächlich zugelassen ist. Für Remdesivir bedeutet das inzwischen: Covid-19-Patient:innen, die Sauerstoff bekommen, aber (noch) keine invasive Beatmung brauchen. Das ist also nur ein Teil der Patient:innen aus den bisherigen Studien.
Inzwischen weiß die Fachwelt auch: Ob Covid-19-Patient:innen auf bestimmte Medikamente ansprechen oder nicht, hängt unter anderem davon ab, wie schwer sie erkrankt sind. Deshalb unterteilt der G-BA die Patientengruppen noch weiter: Auf der einen Seite die mit Low-Flow-Therapie, auf der anderen Seite die mit High-Flow-Therapie oder nicht-invasiver Beatmung. Das soll sicherstellen, einen möglichen Vorteil für bestimmte Gruppen nicht zu übersehen.
Wie das IQWiG bewertet
Was tun, wenn Studien zur gleichen Fragestellung zu widersprüchlichen Ergebnissen kommen? Dann kann eine systematische Übersichtsarbeit helfen, die die Daten im Detail analysiert.
Das macht auch das IQWiG. Alle Beteiligten sind sich einig, dass die Datenlage für einen möglichen Zusatznutzen bei Jugendlichen zu dünn ist. Bei Erwachsenen findet das IQWiG in seiner Auswertung einen deutlichen Unterschied zwischen den beiden Gruppen: Patient:innen mit High-Flow-Therapie oder nicht-invasiver Beatmung profitieren nicht von einer Remdesivir-Behandlung. Bei einer Low-Flow-Therapie scheint es einen Vorteil zu geben: Im Vergleich zur Standardtherapie sterben mit Remdesivir weniger Covid-19-Patient:innen, mehr Behandelte erholen sich.
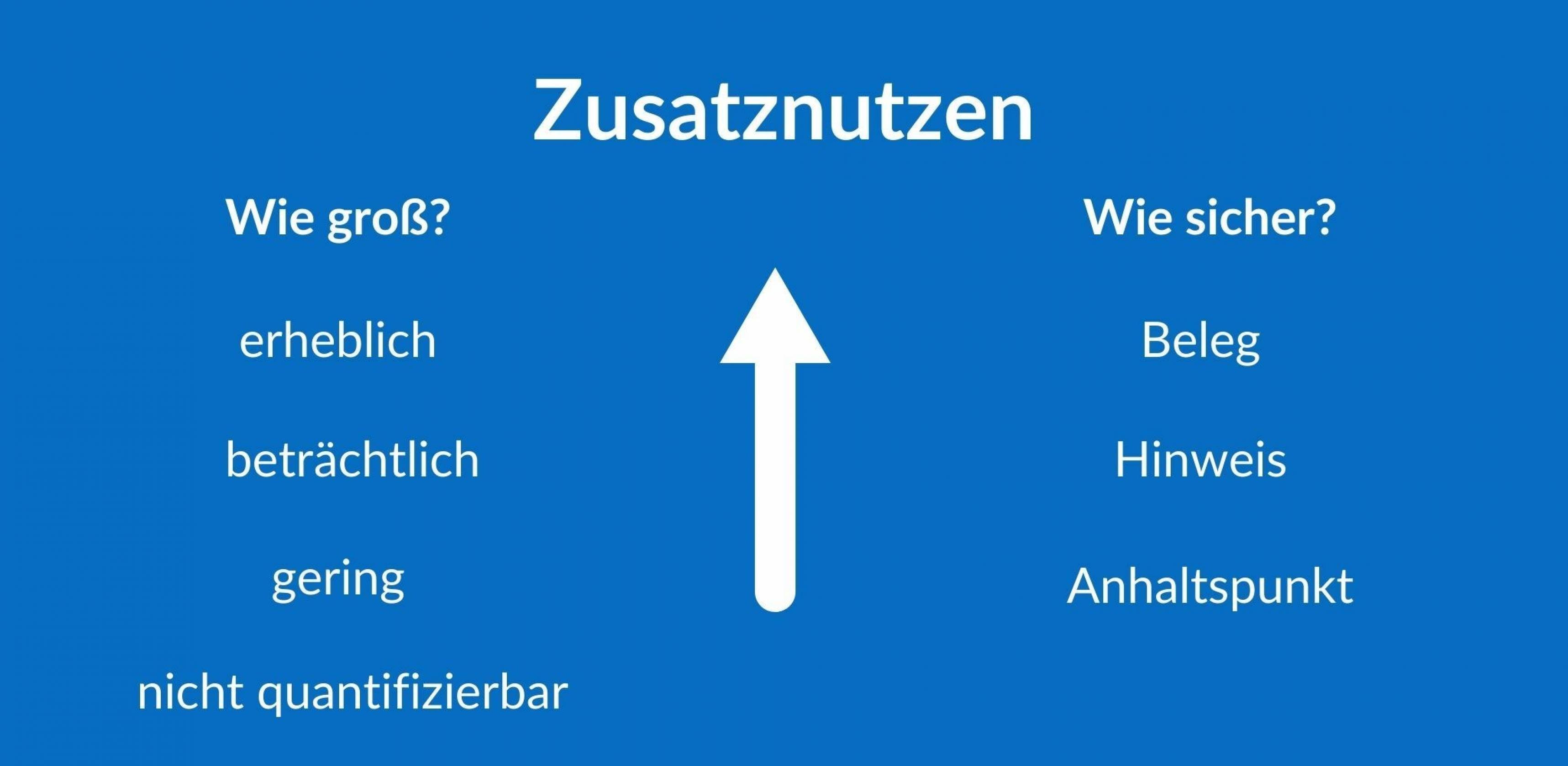
Allerdings gibt es auch einige Unsicherheit, wie groß der Nutzen tatsächlich ist und wie verlässlich die Ergebnisse. Deshalb stuft das IQWiG den Zusatznutzen in beiden Kategorien nur als mittel ein, im Jargon der Nutzenbewertung: Es gibt einen „Hinweis auf einen beträchtlichen Zusatznutzen“ (siehe Grafik). Ob mit Remdesivir mehr Nebenwirkungen auftreten als mit der Standardbehandlung, lässt sich laut Auswertung nicht sicher sagen. Auf der Basis der bisherigen Daten schätzt das IQWiG jedoch, dass Nebenwirkungen nicht so schwerwiegend und häufig sind, dass sie den Zusatznutzen infrage stellen.
Kontroverse Diskussionen
Mit dieser Einstufung sind außer dem Hersteller aber die meisten Anwesenden in der Anhörung nicht einverstanden. Sie plädieren für eine wesentlich niedrigere Einstufung. Ein besonders kontroverser Punkt: Wie sind die Ergebnisse der SOLIDARITY-Studie zu interpretieren? Denn das IQWiG hat sie in seiner Auswertung nicht berücksichtigt.
Der wichtigste Grund dafür: Nur ungefähr 20 Prozent der Teilnehmenden kam aus Europa und Kanada, der Rest aus anderen Ländern der Welt. Besonders in Afrika und Asien ist die medizinische Versorgung oft deutlich anders als in Deutschland. Lassen sich dann die Ergebnisse von SOLIDARITY 1:1 auf Deutschland übertragen? Denn das steht im Fokus der frühen Nutzenbewertung. Deshalb stammen die meisten Daten, auf denen das IQWiG-Gutachten beruht, aus der Zulassungsstudie und der zweiten Hersteller-Studie. Außerdem könne SOLIDARITY für die Analyse nicht viel beitragen, so das IQWiG, denn es fehlt eine Auswertung, die zwischen Low-Flow- und High-Flow-Therapie unterscheidet.
Aber kann man die Ergebnisse der bisher größten Studie mit Remdesivir dann einfach außer Acht lassen? Daran scheiden sich in der Diskussion die Geister. Der radikalste Vorschlag, für den die Arzneimittelkommission der deutschen Ärzteschaft plädiert: Remdesivir soll für keine Gruppe ein Zusatznutzen zuerkannt werden. Etwas zurückhaltender argumentieren Vertreter:innen anderer Fachgesellschaften wie die Deutsche Gesellschaft für Pneumologie: Der G-BA soll nur einen Anhaltspunkt für einen nicht-quantifizierbaren Zusatznutzen beschließen. Übersetzt: Wir haben eine Ahnung, dass Remdesivir etwas bringen könnte. Wir wissen aber nicht, wie viel genau, und insgesamt ist alles unsicher.
Nur begrenzt übertragbar
Einig ist sich die Runde jedoch: Die Ergebnisse der bisherigen Studien lassen sich nur begrenzt auf die aktuelle Situation übertragen. Das ist zu einem guten Teil dem rasanten Erkenntnis-Gewinn in der Pandemie geschuldet: In den Remdesivir-Studien haben nur relativ wenige Patient:innen Dexamethason bekommen, weil dessen Nutzen zu Beginn noch gar nicht bekannt war. Ändert das den Stellenwert von Remdesivir, wenn heute viele Covid-19-Patient:innen im Krankenhaus, die Sauerstoff brauchen, auch mit Dexamethason behandelt werden? Das ist nicht ganz klar.
Womöglich kann Remdesivir auch nur bei früher Gabe helfen. Das wäre nach dem, was inzwischen über Covid-19 bekannt ist, auch plausibel: Wenn in einem späteren Krankheitsstadium Entzündungsreaktionen und Immunprozesse überwiegen, kann ein virushemmendes Mittel nichts mehr ausrichten. Auch diese Erkenntnis war zu Beginn der Studien noch nicht vorhanden.
Was sagen andere?
Das IQWiG-Gutachten ist nicht die einzige gemeinsame Auswertung der Daten zu Remdesivir. Diskutiert wird an diesem Mittag in Berlin auch eine kürzlich veröffentlichte Übersichtsarbeit des internationalen Forschungsnetzwerks Cochrane. Deren Fazit ist zurückhaltend: Zwar finden sich auch in dieser Analyse Hinweise, dass für Patient:innen mit Low-Flow-Therapie Remdesivir hilfreich sein könnte. Allerdings stuft das Autorenteam diese Hinweise als wenig belastbar („low evidence“) ein. Woher kommt der Unterschied zum IQWiG-Gutachten? Das Cochrane-Team teilt auf Anfrage mit, dass ihm die feingliedrigen Daten der zweiten Hersteller-Studie nicht zur Verfügung standen.
Auch die WHO hat die Daten gemeinsam ausgewertet und dabei die SOLIDARITY-Studie berücksichtigt. Danach lässt es sich nicht ausschließen, dass möglicherweise eine kleine Gruppe von Covid-19-Patient:innen doch einen gewissen Nutzen von Remdesivir haben könnte.
Bei den kontroversen Einschätzungen von Remdesivir spielt die Frage eine Rolle: Wie verlässlich sind positive Ergebnisse für einzelne Patientengruppen, wenn die Gesamtbilanz der Studie negativ ausfällt? Solche Subgruppen-Analysen, wie sie im Statistik-Jargon heißen, sind nicht immer einfach zu interpretieren und brauchen genügend verfügbare Daten. Das IQWiG hatte diese Daten nach eigener Einschätzung zur Verfügung, das Cochrane-Team nicht.
Der WHO schließlich waren die Subgruppen-Analysen zu unsicher. Deshalb kam die WHO zu dem Urteil: Remdesivir soll in der Routine-Behandlung von Covid-19-Patient:innen im Krankenhaus eher nicht eingesetzt werden, höchstens in weiteren Studien. Allerdings nimmt die WHO-Empfehlung die weltweite Versorgung in den Blick, nicht nur die in ressourcenstarken Ländern mit hohen medizinischen Standards.
Wie der G-BA entscheidet
Nach der Anhörung geht die Diskussion im G-BA weiter. Schließlich kommt der Ausschuss zu dem Beschluss: Für Patient:innen mit Low-Flow-Therapie besteht ein Anhaltspunkt für einen geringen Zusatznutzen. Das ist also eine niedrigere Einstufung als die des IQWiG. Die Begründung stützt sich aber nur auf die schnellere Erholung, eine geringere Sterblichkeit sieht der G-BA nicht als gesichert an. Bei Covid-19-Patient:innen mit High-Flow-Therapie teilt das Gremium die Einschätzung des IQWiG, dass ein Zusatznutzen nicht belegt ist. Welcher Preis für Remdesivir angesichts dieser Bewertung angemessen ist, verhandeln jetzt Krankenkassen und Hersteller.
Mehr Daten, mehr Verwirrung
Die Geschichte wird aber noch komplizierter. Denn im September 2021 wird die DISCOVERY-Studie veröffentlicht. Sie vergleicht in verschiedenen europäischen Ländern Remdesivir mit der Standardversorgung bei mehr als 800 Covid-19-Patient:innen. Danach hat Remdesivir insgesamt keinen Vorteil: weder in der Gruppe mit Low-Flow-Therapie noch in der Gruppe mit High-Flow-Therapie oder invasiver Beatmung.
Ändert die DISCOVERY-Studie jetzt in der Gesamtschau aller Daten die Bewertung? Thomas Kaiser, einer der Leiter des Ressorts Arzneimittelbewertung im IQWiG, ist sich da nicht so sicher: „Die DISCOVERY-Studie hat ein etwas anderes Ergebnis als die Zulassungsstudie, aber auf den ersten Blick ist es unklar, ob das die Gesamtauswertung in Frage stellt.“ So haben etwa einige Patient:innen, aber nicht alle, Dexamethason bekommen. Eine getrennte Auswertung fehlt aber bisher.
Ein erneutes Gutachten inklusive der DISCOVERY-Studie könnte das IQWiG erstellen, wenn der G-BA einen entsprechenden Auftrag erteilt. Ob es aber dazu kommt, ist derzeit noch offen. „Die DISCOVERY-Studie werden sich unsere Fachleute ansehen und prüfen“, antwortet eine Sprecherin des G-BA auf Anfrage. „Sollte es hierbei neue wissenschaftliche Erkenntnisse geben, spricht grundsätzlich nichts dagegen, das Bewertungsverfahren erneut aufzurollen.“ Auch das Cochrane-Team prüft derzeit die DISCOVERY-Daten.
Was die Leitlinie sagt
Was sollen jetzt Ärztinnen und Ärzte mit dieser komplexen Datenlage machen? Damit beschäftigt sich die deutsche Leitlinie zur Krankenhaus-Behandlung von Covid-19-Patient:innen. Sie stützt sich auf die Studien und die Cochrane-Auswertung. Klar ist die Leitlinie für Patient:innen, die keinen Sauerstoff brauchen oder invasiv beatmet werden: Sie sollen definitiv kein Remdesivir bekommen. Und für Patient:innen mit Low- oder High-Flow-Therapie oder einer nicht-invasiven Beatmung? Es „kann weder eine Empfehlung dafür noch gegen eine Therapie mit Remdesivir abgegeben werden“, lautet das Fazit.
Und jetzt?
November 2021. Die WHO meldet knapp 5 Millionen Covid-Tote weltweit. Es steht zu befürchten, dass die Zahl der Todesopfer über den Winter weiter steigen wird. Auch in Deutschland. Die Auffrischungsimpfungen haben begonnen.
Inzwischen haben in Studien mehr als 8.000 Patient:innen Remdesivir bekommen. Und vermutlich noch deutlich mehr in den Covid-Stationen der Krankenhäuser, ohne dass die Ergebnisse dokumentiert sind. Dennoch lässt es sich nicht mit letzter Sicherheit sagen, ob und für wen Remdesivir eine gute Wahl ist. Klar ist nur: Remdesivir ist nach dem heutigen Kenntnisstand definitiv kein Game Changer, der alle Covid-19-Patient:innen retten könnte.
Der Hersteller hat inzwischen bei der EMA beantragt, die Zulassung von Remdesivir zu erweitern: für Patient:innen in einem sehr frühen Krankheitsstadium, die keinen Sauerstoff benötigen. Das ist die Gruppe, die zumindest theoretisch am meisten profitieren könnte. Die Daten aus den bisherigen Studien scheinen aber nicht so eindeutig zu sein: Zumindest hat der zuständige Ausschuss der EMA bereits zweimal weitere Auswertungen angefordert.
Es bleibt also nach wie vor kompliziert mit Remdesivir.
Aber womöglich hat sich demnächst die Frage erledigt, wem das Medikament tatsächlich nützt: Denn im Rennen um nützliche Therapien gegen Covid-19 gibt es Konkurrenz. In den Startlöchern stehen virushemmende Arzneistoffe mit einem wesentlichen Vorteil: Sie wird es als Tablette geben – ein wichtiges Plus, wenn eine Behandlung bei Covid-19 möglichst früh beginnen soll. Für Remdesivir ist dagegen eine Infusion nötig. Für den virushemmenden WirkstoffMolnupiravir hat die EMA bereits mit den ersten Schritten für die Zulassung begonnen. Ob er und andere ähnliche Medikamente Remdesivir überflüssig machen, wird sich zeigen.
Update 09.09.2022: Hier gibt es den zweiten Teil der Geschichte.