- RiffReporter /
- Wissen /
Wichtige Meldungen aus der Epigenetik: revolutionäres Forschungsgebiet im Wandel der Zeit
Neues zu Demenz, Krebs, Vererbung von Trauma und Gesundheit: 14 Epigenetik-Meldungen aus 14 Jahren
Seit 2010 sind 37 „Newsletter Epigenetik“ erschienen. Insgesamt kamen mehr als 850 Meldungen aus einem der wichtigsten Forschungsgebiete unserer Zeit zusammen. Jetzt wird der Newsletter in die „Sporks Science News“ integriert. Zum Abschied eine Sammlung der wichtigsten News.

„Das Zeitalter der Epigenetik hat begonnen“ schrieb dasTime Magazineim Jahr 2010 in einer Titelgeschichte. Darin erklärte das US-amerikanische Blatt, dass „unsere Gene nicht unser Schicksal sind“. Ich hatte das schon ein Jahr früher erkannt, als mein Buch „Der zweite Code“ erschien. Es war das weltweit erste seriöse populärwissenschaftliche Sachbuch zur Epigenetik.
Damit die Menschen einen Einblick in dieses Forschungsgebiet bekommen, startete ich den Newsletter Epigenetik. Die erste Ausgabe erschien im April 2010. Seitdem stellte das Magazin in 37 Ausgaben mehr als 850 wichtige Studien und andere Neuigkeiten aus dem Feld der Neben- oder Zusatzgenetik vor. Die Zahl der Interessierten ist stetig gewachsen, darunter auch bedeutsame Forschungsinstitute, die den Newsletter für ihre Mitarbeitenden abonniert haben.
Die Epigenetik erforscht Strukturen, die an oder neben den Genen sitzen und diese wie ein Dimmer oder ein Schalter regulieren. Auf diesem Weg legen epigenetische Markierungen die Identität einer Zelle fest und schenken ihr ein Gedächtnis für Umwelteinflüsse.
Die Epigenetik ist „die Sprache, in der die Umwelt mit den Genen spricht“, sagte einst der Stammzellforscher Rudolf Jaenisch vom MIT in Boston, USA. Die neue Wissenschaft, die eine Tochterdisziplin der Genetik ist, erklärt, was Lebewesen prägt. Epigenetik entscheidet, wie wir werden, was wir sind und sie wird uns in Zukunft dabei helfen, unsere Gesundheit selbst zu lesen. All diese Perspektiven haben die Epigenetik zu einem der wichtigsten Forschungsgebiete unserer Zeit gemacht.
Jetzt ist der Newsletter Epigenetik umgezogen und seit kurzem fester Bestandteil der im zwei-Wochen-Rhythmus erscheinenden Sporks Science News. Anlass genug, die wichtigsten vierzehn Meldungen aus vierzehn Jahren für Sie zusammenzustellen. Aus jedem Jahr habe ich eine besondere Meldung ausgewählt. Entstanden ist ein lebendiges, abwechslungsreiches Dokument des noch jungen Forschungszweigs auf dem Weg zum Erwachsenwerden. Reisen Sie gerne gemeinsam mit mir und den Originalmeldungen von damals durch das Zeitalter der Epigenetik.
2010: „Epigenetische Signatur“ der Altersdemenz gefunden
Kommentar: J. David Sweatt: Epigenetics and cognitive aging. Science 328,07.05.2010, S. 701–702.
Veränderungen der Epigenetik von Gehirnzellen sorgen vermutlich für die zunehmende Gedächtnisschwäche im Alter. Diese neue Erkenntnis könnte eines Tages zur Behandlung von Altersdemenz und Morbus Alzheimer beitragen. Ein Forscherteam um André Fischer vom European Neuroscience Institute in Göttingen (ENI)fand in Experimenten mit Mäusen heraus, dass die Gehirnzellen älterer Tiere nicht mehr in ein spezielles epigenetisches Programm umschalten und deshalb keine Gedächtnisinhalte mehr konsolidieren können.
Die Forscher untersuchten Nervenzellen des Hippokampus, einer bei Mäusen wie Menschen für Lernvorgänge wichtigen Struktur. An Position 12 vieler Histone H4 (H4 K12) wird dort beim Lernen normalerweise eine Acetylgruppe angelagert. Diese Modifikation des Histon-Codes aktiviert bei jungen Mäusen 1.500 Gene, deren Produkte Lernvorgänge unterstützen.

Bei 16 Monate alten Mäusen ist die Fähigkeit zur Histonacetylierung an dieser Stelle jedoch verloren gegangen. Dadurch bleiben nahezu alle „Lern-Gene“ stumm geschaltet; die Tiere können sich kaum etwas merken.
André Fischer hofft, eine „epigenetische Signatur“ gefunden zu haben, die helfe, dementielle Erkrankungen aller Art unabhängig von ihrem Auslöser frühzeitig erkennen und behandeln zu können. In einem zweiten Experiment gelang es den Forschern bereits, die Lernfähigkeit der alten Tiere pharmakologisch zu neuem Leben zu erwecken: Sie gaben den Mäusen einen Histondeacetylase-Hemmer, der die Entfernung von Acetylgruppen an Histonen unterdrückt. Daraufhin konnten die Tiere wieder lernen.
2011: Epigenetik und die „German Angst“
www.mpg.de/17094441/hv-2011-gruss.pdf%20
Der Präsident der Max-Planck-Gesellschaft, Peter Gruss, hält es für möglich, dass die Epigenetik „eines Tages die molekularbiologischen Grundlagen für das Phänomen der ‚German Angst‘ liefert“. So äußerte er sich in einer viel beachteten Rede am 9. Juni auf der Festversammlung der Max-Planck-Gesellschaft in Berlin. Dass die Deutschen auf potenzielle Bedrohungen besonders sensibel reagieren, dass sie gar auf manche Chance mit großer Skepsis antworten, werde international als „German Angst“ bezeichnet.
Die Epigenetik mache es nun denkbar, dass dieses Verhalten eine Folge der Traumata sei, die „unsere Eltern und Großeltern vor über 60 Jahren erlitten haben“. Es kann gut sein, dass nun auch die Bundeskanzlerin auf das Kernthema dieses Newsletter Epigenetik aufmerksam geworden ist. Angela Merkel soll jedenfalls aufmerksam zugehört haben.
2012: Vernachlässigung kleiner Kinder hinterlässt bleibende Spuren
Zu den berühmtesten Befunden der Epigenetik gehört, dass Ratten, die in ihren ersten Tagen kaum umsorgt werden, eine epigenetische Besonderheit aufweisen, die sie zeitlebens ängstlich und aggressiv macht. Natürlich wird diskutiert, ob diese Resultate auf den Menschen übertragbar sind. Einige Untersuchungen sprechen dafür. Zudem ist bekannt, dass Menschen, die in früher Kindheit Gewalterfahrungen erlitten, später ein erhöhtes Depressionsrisiko haben.
Jetzt schließt sich die Indizienkette: Neurowissenschaftler*innen aus den USA untersuchten die Epigenome in Blutzellen von 99 gesunden Erwachsenen und befragten sie nach ihrer Kindheit und dem Grad der elterlichen Fürsorge. Dann machten sie einen Stresstest. Tatsächlich schnitten Proband*innen, die einst vernachlässigt oder traumatisiert worden waren, im Stresstest besonders empfindlich ab.
Vor allem aber besaßen sie die gleiche epigenetische Besonderheit wie schlecht umsorgte Ratten: eine starke Methylierung am Gen eines Rezeptors für das Stresshormon Cortisol. Diese Veränderung machen Forscher für eine zeitlebens anhaltende erhöhte Stressverwundbarkeit verantwortlich.
2013: Hat Homosexualität epigenetische Ursache?
Mathematiker*- und Evolutionsbiolog*innen um Sergey Gavrilets von der University of Tennessee stellen ein neues Modell zur Entstehung der Homosexualität zur Diskussion. Demnach verfestigen epigenetische Markierungen an Genen, die auf das männliche Sexualhormon Androsteron reagieren, die gewöhnliche Entwicklung. Diese Markierungen sollen die Wirkung des Hormons bei männlichen Kindern verstärken und sie bei weiblichen verringern und unterstützen so die Ausprägung der Geschlechter.
Normalerweise werden solche epigenetische Schalter aber nicht an die folgende Generation vererbt. Geschieht dies in Ausnahmefällen doch, und gelangt dieser geschlechtsspezifische Teil des Epigenoms zumindest teilweise zu einem Nachfahren des anderen Geschlechts, dann könnte das in der Theorie die Prägung des Geschlechts beeinflussen und zur Homosexualität beitragen.
Dieses Modell würde das Rätsel erklären, dass es zwar Hinweise auf die Erblichkeit der Homosexualität gibt, dass man aber keinerlei genetische Markierung finden kann und eineiige Zwillinge nur selten beide homosexuell sind. Gavrilets und Kollegen schlagen sogar einen Test ihrer These vor: Man müsse die Epigenome der Spermien von Vätern mit und ohne homosexuelle Tochter vergleichen und sollte darin eigentlich systematische Unterschiede finden.
2014: Mäuse vererben ihre Angst
Mit einem geschickten Versuchsansatz gelang es Brian Dias und Kerry Ressler aus den USA, in schlüssiger Weise zu belegen, dass Säugetiere Erfahrungen an folgende Generationen über eine epigenetische Veränderung der Keimbahn weitergeben können. Bislang ist noch immer umstritten, ob eine solche transgenerationelle epigenetische Vererbung bei Säugetieren und beim Menschen überhaupt möglich ist.
Zunächst konditionierten die Forschenden männliche Mäuse mit schwachen Stromstößen darauf, Angst vor dem Kirschduft Acetophenon zu entwickeln. Der Sensor für diesen Duft in der Nase der Tiere ist bekannt. Er wird von einem einzigen Gen namens Olfr151 codiert. Dann wiesen Dias und Ressler nach, dass die kurz darauf gezeugten Nachfahren der nächsten und auch jene der übernächsten Generation überempfindlich auf den gleichen Duft reagierten, obwohl sie ebenso wie die Mutter keine negativen Erfahrungen damit gemacht hatten. Gegenüber anderen Düften verhielten sie sich normal.
Verantwortlich war wohl der Umstand, dass sich besonders viele der entsprechenden Rezeptoren in der Riechschleimhaut der Tiere befanden. Und das könnte wiederum in einer epigenetischen Veränderung der Samenzellen ihrer Väter begründet sein: Sowohl die Spermien der konditionierten Männchen als auch jene ihrer Jungen hatten am Olfr151-Gen besonders wenige Methylgruppen angelagert. Diese epigenetische Botschaft erlaubt den Zellen meist, ein Gen besonders gut abzulesen.
Um auszuschließen, dass die Väter ihre Nachkommen oder deren Mutter über ihr Verhalten beeinflussten, wurden sie direkt nach der Zeugung abgesondert. In einem kleinen Teil der Experimente setzten die Forscher sogar künstliche Befruchtung ein oder ließen die Jungen von fremden Müttern aufziehen. Am Ausgang des Versuchs änderte das nichts.
2015: Epigenetische Veränderung löst „ADHS-Bremse“ bei Ratten
Eines der bekanntesten Beispiele für die frühkindliche epigenetische Prägung der Persönlichkeit sind Kinder so genannter Non-Licking-Rats („nicht leckende Ratten“): Wenn sich Rattenmütter in den ersten Tagen nach der Geburt nur wenig um ihren Nachwuchs kümmern, ihn zum Beispiel nicht ablecken, wird das Gen für eine wichtige Stresshormon-Andockstelle (Glucocorticoid-Rezeptor) an einer bestimmten Stelle des Gehirns (Hippocampus) nicht ausreichend von Methylgruppen befreit. So bleiben diese epigenetischen Riegel erhalten, die Ratten bilden nur wenige Stresshormon-Rezeptoren und haben zeitlebens eine überempfindliche Stressregulation.
Nun fanden Forschende aus den USA heraus, dass ganz ähnliche Prozesse in einer anderen Hirnregion und am Gen eines anderen Rezeptors womöglich an der Entstehung von Persönlichkeitsstörungen wie dem Aufmerksamkeits-Defizit und Hyperaktivitätssyndrom (ADHS), Autismus oder Schizophrenie beteiligt sind. Bestätigen sich die Resultate und lassen sie sich eines Tages auf den Menschen übertragen, würde das einmal mehr bedeuten, dass epigenetische Veränderungen aus der Zeit um die Geburt einen wichtigen Anteil am späteren Risiko für psychiatrische Erkrankungen aller Art haben.
Stacey Kigar und Kollegen hemmten – übrigens per RNA-Interferenz, also epigenetisch – bei Ratten die Produktion eines Proteins namens Gadd45 b. Das taten sie direkt nach der Geburt der Tiere, und sie taten es gezielt im Angstzentrum des Gehirns, den Mandelkernen, auch Amygdalae genannt. Der Clou: Man nimmt an, dass Gadd45 b die Zellen bei der aktiven Entfernung von Methylgruppen von der DNA unterstützt. Fehlt es, gelingt es Zellen also nicht mehr so gut, epigenetisch abgeschaltete Gene wieder in den aktivierbaren Modus umzuschalten.
Tatsächlich zeigten die so behandelten Tiere im Alter von drei Wochen, was bei Menschen etwa dem Alter von Jugendlichen entspräche, ein besonders ausgeprägtes rohes und rabaukiges Spielverhalten, das man durchaus als eine Art Ratten-ADHS bezeichnen kann. Gleichzeitig waren einige Gene weniger aktiv als gewöhnlich, von denen man weiß, dass ihre Fehlregulation bei Persönlichkeitsstörungen eine Rolle spielt.
Vor allem aber war das Gen für einen Rezeptor namens Adra2 a epigenetisch ungewöhnlich stark per DNA-Methylierung unterdrückt. Dieser Rezeptor ist exakt jene Andockstelle, die das ADHS-Medikament Ritalin aktiviert, das heißt, er fungiert wie eine Bremse für übertriebenes Spielverhalten. Haben die Tiere wenige dieser Rezeptoren, neigen sie offenbar zu einer besonders ungezügeltem Persönlichkeit.
Die epigenetisch aktive Substanz Gadd45 b „spielt also eine bislang unbekannte Rolle bei der Organisation des Sozialverhaltens in der Amygdala“, schreibt Kigar in einem Beitrag für das Internetportal EpiBeat. Auch wenn die Forscher das Phänomen künstlich herbeiführten, so ist doch anzunehmen, dass prägende Umwelteinflüsse in einem sensiblen Zeitfenster vergleichbare Wirkungen haben können. Warum sollte in den Amygdalae nicht auch gelten, was im Fall der Non-Licking-Rats für den Hippocampus gesicherte Erkenntnis ist?
2016: Nachhaltige Spuren früher Traumata
Dass frühkindliche Traumatisierungen beim Menschen zeitlebens das Risiko für Stresskrankheiten aller Art erhöhen, darunter nahezu alle psychischen Störungen aber auch Stoffwechselkrankheiten und sogar Krebs, wurde bereits in vielen epidemiologischen Studien gezeigt. Verantwortlich für diesen Zusammenhang sind sehr wahrscheinlich epigenetische Veränderungen in solchen Zellen, die an der Stressregulation mitwirken. Das schließt man aus zahlreichen Tierversuchen, aber auch aus einigen Analysen mit Menschen (siehe zB Newsletter Epigenetik 02/12: Vernachlässigung kleiner Kinder hinterlässt bleibende Spuren und 04/11: Stress und seine epigenetischen Folgen).
Jetzt fanden gleich zwei Forscherteams weitere Hinweise auf diesen Zusammenhang und präsentieren epigenetische Markierungen in leicht zugänglichen Blut- oder Mundschleimhautzellen, die womöglich nachhaltige Spuren früher Traumata sind. Bestätigen sich die Resultate und ließen sie sich auf Gehirnzellen übertragen, worauf es durchaus Hinweise gibt, gäbe es nicht nur neue Einsichten in die Mechanismen, mit denen frühkindliche Gewalterfahrungen und Vernachlässigung das spätere Krankheitsrisiko verändern. Man hätte womöglich auch geeignete Biomarker gefunden, die selbst später im Leben noch Hinweise auf frühe Traumatisierungen geben.
Lotte Houtepen von der Universität Utrecht und Kollegen werteten Blutproben von 85 gesunden Erwachsenen aus und machten mit den Proband*innen Stresstests. Dabei zeigte sich ein klarer Zusammenhang zwischen der Intensität, mit der die Menschen per Stresshormon-Anstieg auf die Belastung reagierten und epigenetischen Veränderungen an einem Gen namens KITLG: Je abgestumpfter die Stressreaktion desto mehr Methylgruppen waren an der Kontrollregion des Gens an die DNA angelagert und desto schlechter aktivierbar dürfte dieses gewesen sein.
Zudem war der Histon-Code in einer benachbarten Verstärkerregion (Enhancer) verändert. Beides scheint eine sinnvolle Anpassung zu sein, denn das von KITLG kodierte Protein verstärkt anderen Beobachtungen zufolge die Bildung von Stresshormonrezeptoren. Vor allem aber waren die Effekte verbunden mit frühkindlichen Gewalterfahrungen der Probanden. Zwei Wiederholungen der Analysen mit Proben von Blut- und Mundschleimhautzellen anderer Proband*innen bestätigten größtenteils die Befunde.
Ähnliche Resultate stellte ein internationales Team um Robert Kumsta von der Ruhr-Universität Bochum vor. Die Forscher analysierten die Epigenome der Mundschleimhautzellen von 49 Erwachsenen, die als Kinder adoptiert worden waren. Zwei Drittel lebten in den 1980er Jahren unter menschenunwürdigen Bedingungen in rumänischen Heimen und waren teils über lange Zeit, teils über einen kürzeren Zeitraum stark vernachlässigt worden. Die dritte Gruppe waren britische Bürger, die in ihrer Kindheit keine Vernachlässigung erleben mussten.
Es zeigte sich, dass eine bestimmte DNA-Region im Umfeld des Gens CYP2 E1 nur in der Gruppe jener Erwachsener besonders stark methyliert war, die in ihrer Kindheit besonders lange vernachlässigt worden waren. Diese epigenetische Besonderheit ging einher mit typischen sozialen Defiziten, wie sie von einst vernachlässigten Menschen bekannt sind. Auch wenn nicht klar ist, welche der Auffälligkeiten den Anfang machte, so dürfte auch hier die frühkindliche Traumatisierung lebenslange Spuren in den Epigenomen der Menschen hinterlassen haben.
2017: Die Alters-Uhr zurückdrehen
Es gibt zunehmend Hinweise, dass die Alterung von Organismen ein epigenetisch gesteuerter Prozess ist. So lässt sich das biologische Alter eines Menschen gut anhand epigenomischer Daten vorhersagen. Jetzt zeigt sich, dass die Rechnung auch umgekehrt aufgeht: Forscher reprogrammierten die Epigenome von Mäusen, die wegen einer Mutation besonders rasch alterten, ein Stück weit in die gleiche Richtung, wie es bei der Nobelpreis-gekrönten Herstellung so genannter induzierter pluripotenter Stammzellen (iPS-Zellen) mit isolierten erwachsenen Zellen etwa aus der Haut geschieht. Daraufhin lebten die Mäuse deutlich länger als Mitglieder einer unbehandelten Kontrollgruppe.
Im Jahr 2012 erhielt der Japaner Shinya Yamanaka den Medizin-Nobelpreis, weil es ihm gelungen war, mit Hilfe vierer Substanzen – den Yamanaka-Faktoren – das Epigenom ausgewachsener Zellen so zu reprogrammieren, dass sie nahezu vollständig in den Urzustand einer embryonalen Stammzelle zurückkehrten. Die derart veränderten Zellen können theoretisch in jedes denkbare Gewebe ausdifferenzieren und als genetisch identischer Ersatz Verwendung finden. Bislang wurden allerdings nur Zellkulturen mit den Yamanaka-Faktoren behandelt. Die Gefahr ist zu groß, dass die Gabe der epigenetisch aktiven Substanzen Zellen außer Kontrolle geraten lässt und gefährliche Krebsgeschwulste entstehen.
In der neuen Studie wendeten Forscher aus Spanien und den USA aber ein trickreiches Verfahren an, bei dem sie die Aktivität der Yamanaka-Faktoren über den Zusatz eines Antibiotikums gezielt steuern konnten. Dadurch wurden die Mäuse immer nur für zwei bis vier Tage epigenetisch verjüngt und nicht, wie bei der vollständigen Reprogrammierung in Zellkultur nötig, über mehrere Wochen hinweg.
Diese Prozedur bewirkte eine teilweise Verjüngung vieler Gewebe und erhöhte merklich die Lebenserwartung der Tiere. Bösartige Veränderungen oder Fehlbildungen traten hingegen nicht auf. Für die Forscher erscheint nun sogar eine Art Jungbrunnentherapie des Menschen am Horizont. Ihre Entdeckung sei womöglich der Beginn einer neuen Strategie zur Bekämpfung von Alterskrankheiten aller Art.
2018: Epigenom-Editierung ahmt Entstehung von Brustkrebs nach
Pressemeldung, Barts Cancer Institute, 13.11.2017: Epigenetic editing: not just a one 'hit’ wonder.
Dass Krebszellen eine Reihe auffälliger epigenetischer Veränderungen besitzen, ist lange bekannt. Man weiß auch, dass viele von diesen typisch für Krebs sind und dass man viele Arten von Krebs auch durch eine systematische – epigenomische – Analyse der epigenetischen Markierungen unterscheiden kann.
Wie bei anderen Krankheiten auch, ist aber oft unklar, ob die epigenetischen Veränderungen als Antreiber mitverantwortlich für die Entstehung des Krebses sind oder nur eine passive Folge bösartiger Veränderungen (siehe dazu auch die Meldung Henne oder Ei). Jetzt haben Forschende um Gabriella Ficz von der Londoner Queen Mary University das berühmte neue gentechnische Präzisionsinstrument CRISPR/Cas genutzt, um die Epigenome gesunder Brustzellen gezielt zu verändern und damit in Richtung Bösartigkeit zu treiben. Das Experiment liefert Indizien, dass epigenetische Veränderungen sehr wohl den Anfang einer Krebserkrankung markieren können.
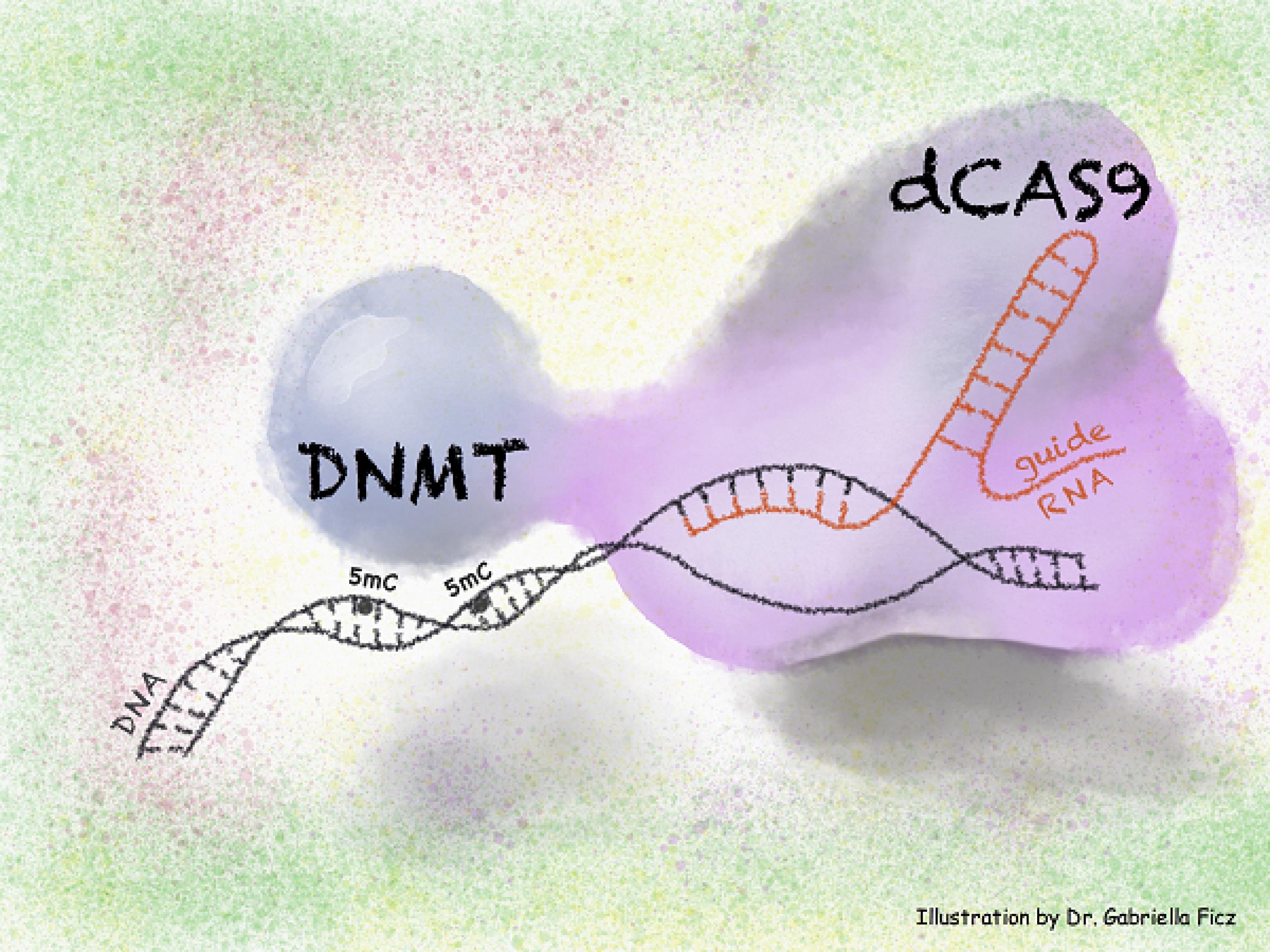
CRISPR/Cas ist vor allem deshalb in den Schlagzeilen, weil Forscher*innen damit gezielt den genetischen Code editieren können. Die wenigsten wissen aber, dass es mit einer modifizierten Form der Technik genauso gut gelingt, das epigenetisch wichtige Muster der DNA-Methylierung zu verändern – ganz ohne den Text der DNA überhaupt anzurühren (siehe Grafik).
Mit Hilfe dieser Epigenom-Editierung haben Ficz und Kolleg*innen nun in Zellkulturen lebende gesunde Brustzellen so manipuliert, dass einige wichtige, bei Krebs oft besonders stark methylierte Gene durch die künstlich herbeigeführte DNA-Methylierung nicht mehr aktivierbar waren. Infolgedessen nahmen die Zellen krebstypische Eigenschaften an, unter anderem teilten sie sich besonders rasch und gelangten kaum noch in das als zelluläre Seneszenz bezeichnete Ruhestadium, mit dem sich der Körper eigentlich vor Krebs schützt (siehe auch die Meldung Dunkle Seite der Chemotherapie). Maßgeblich scheint dabei vor allem die geringere Aktivität des Gens p16 zu sein, das schon länger als so genanntes Tumorsuppressor-Gen gilt – als Gen, dessen Aktivität Krebs unterdrückt.
Bemerkenswert ist, dass die epigenetische Veränderung von den sich rasch teilenden Zellen an ihre Töchter vererbt wurde. Sie blieb also bestehen und breitete sich sogar aus, obwohl die Editierung des Epigenoms mit CRISPR/Cas nur anfangs eingesetzt worden war. Es sei erstaunlich, dass die Zellen verschiedener gesunder Menschen „empfänglich sind für diese epigenetische Veränderung und das ein einmaliger Treffer mit dem epigenetischen Editierungswerkzeug ausreicht, eine Kettenreaktion in Gang zu setzen, an deren Ende eine krebszellartige Signatur der Genaktivität steht“, kommentiert Gabriella Ficz die Resultate ihres Teams in einer Pressemitteilung.
Die Ergebnisse zeigten deshalb auch, dass und wie epigenetische Veränderungen eine Krebserkrankung antreiben könnten. Die erfolgreiche Epigenom-Editierung diene aber in Zukunft sicher nicht nur der Grundlagenforschung. Man könne das Werkzeug vielleicht sogar dafür nutzen, neuartige Therapien zu entwickeln. Da diese nur das Epigenom beträfen, veränderten sie zwar dauerhaft die Biologie von Zellen, täten dies aber nicht so tiefgreifend und unumkehrbar, wie eine Gentherapie.
2019: Medikament lindert Folgen von Vernachlässigung
Nagetiere sind gute Modelltiere für die Erforschung der frühkindlichen Prägung. Eine Menge Studien, über die oft auch an dieser Stelle berichtet wurde, legen bereits nahe, dass für die Prägung epigenetische Veränderungen maßgeblich sind. Dennoch gelang es bisher nicht, die negativen Folgen frühkindlicher Vernachlässigung bei bereits erwachsenen Tieren mit Hilfe epigenetisch aktiver Medikamente rückgängig zu machen. Diesen wichtigen Nachweis lieferten nun drei Hirnforscher*innen von der University of Delaware in Newark, USA.
Samantha Keller und Kolleginnen zeigten zunächst, dass Ratten, die als Neugeborene vernachlässigt worden waren, oft auch ihren eigenen Nachwuchs vernachlässigen. Ein Auslöser könnte eine epigenetische Veränderung am Gen für den Nervenwachstumsfaktor BDNF in einer bestimmten Hirnregion sein, die für das Fürsorgeverhalten wichtig ist (mediales präoptisches Areal).

Schließlich behandelten die Forscher*innen die Ratten kurz nach der Geburt ihrer Kinder mit dem Medikament Zebularin, das die Methylierung der DNA verringert. Das Fürsorgeverhalten dieser Tiere normalisierte sich, die Epigenetik am untersuchten Gen ebenfalls, und das Gen wurde genauso stark abgelesen wie bei gewöhnlichen Ratten.
Das Medikament setzt allerdings vermutlich an einer vorgeschalteten Stufe an, da das BDNF-Gen nun sogar stärker methyliert war als zuvor. Dafür spricht auch eine weitere Beobachtung: Ratten, die als Jungtiere nicht abgelehnt worden waren, veränderten sich durch das Zebularin in die ungewünschte Richtung. Sie begannen, ihre Jungen zu vernachlässigen.
Für die Beeinflussung der menschlichen Psyche kommt das Medikament zwar nicht in Betracht. Aber die Experimente belegen eindrucksvoll, dass es wohl tatsächlich die Epigenetik ist, die die Tiere und wahrscheinlich auch uns Menschen zeitlebens prägen kann. Man sollte deshalb in Zukunft zur Bekämpfung von Fehlentwicklung auch auf so genannte sanftere Ansätze zurückgreifen, die die Epigenetik ebenfalls verändern: Psychotherapie, Ernährung oder Bewegung zum Beispiel, schreiben Keller und Kolleginnen. Sie regen an, nun auch die Wirkung solcher Einflüsse auf vernachlässigte Ratten zu untersuchen.
2020: Epigenetische Medikamente im Kampf gegen Krebs
„Auch wenn es im Jahr 2020 schon neun zugelassene epigenetische Mittel gibt, so geht die Arbeit an der Verbesserung der Behandlung von Blutkrebs und soliden Tumoren unverändert weiter.“ So lautet das Fazit der Hämato-Onkologin Susan Bates von der Columbia University in New York in einem ausführlichen, sehr lesenswerten Übersichtsartikel über epigenetische Krebstherapien. Sie schildert das Einsatzfeld der existierenden Medikamente, beschreibt, welche Mittel zusätzlich in den Pipelines der Pharmakonzerne stecken, macht sich Gedanken über die verschiedenen Wirkmechanismen und weist auch kritisch darauf hin, dass es auf dem Gebiet noch erstaunlich viele offene Fragen gibt.
Die so genannten DNMT-Hemmer Azacitidin und Decitabin, die Methylgruppen von der DNA entfernen und Krebszellen damit epigenetisch zum Guten verändern können, sind schon seit mehr als zehn Jahren in den USA und Europa zugelassen. Sie werden gegen die Blutkrebsarten Akute Myeloische Leukämie (AML), das myelodisplastische Syndrom und die myelomonozytäre Leukämie eingesetzt.
Im Einsatz gegen solide Tumoren zeigten sie aber keine überzeugende Wirkung. Zwei weitere Substanzen, die auf einem ganz anderen Weg dazu beitragen, dass die DNA von Krebszellen weniger Methylgruppen trägt, sind Enasidenib und Ivodinesib. Sie hemmen zielgenau ein Protein, das oft in Krebszellen so verändert ist, dass es eine schädliche epigenetische Wirkung hat. Im Jahr 2017 und 2018 wurden sie in den USA für den Einsatz gegen AML zugelassen.
Auch einige der Substanzen, die Enzyme der Gruppe der Histondeacetylasen hemmen, kurz HDAC-Hemmer genannt, sind fast schon Klassiker: Vorinostat, Belinostat, Panobinostat und Romidepsinsind in den USA zugelassen, Chidamid in China. Sie lockern das Chromatin genannte Protein-DNA-Gemisch auf, indem sie die Enzyme daran hindern, Acetylgruppen von den Histonproteinen zu entfernen. Das macht stillgelegte Gene wieder aktivierbar und hilft besonders überzeugend im Kampf gegen das Kutane T-Zell-Lymphom. Manche der Mittel werden auch gegen periphere Lymphome oder in Kombination mit anderen Mitteln gegen Multiple Myelome eingesetzt.
Hoffnungen setzt Susan Bates auch auf Stoffe, die Enzyme hemmen, die Methylgruppen an Histone anlagern. Eine dieser Histonmethyltransferasen heißt EZH₂, und ein Medikament namens Tazemetostat, das EZH₂ hemmt, zeigte in einer Studie im Kampf gegen follikuläre Lymphome so gute Resultate, dass es im Juni 2020 von den zuständigen Behörden in den USA zugelassen wurde. Ähnliches Potenzial traut die Autorin weiteren EZH₂-Hemmern zu, die derzeit in der Entwicklung stecken.
Diesen und den meisten der zahlreichen anderen, zurzeit von Firmen überall auf der Welt entwickelten epigenetischen Antikrebsmedikamenten ist eines gemein: Sie wirken ungleich zielgenauer als die epigenetischen Mittel der ersten Generation. Moderne HDAC-Hemmer blockieren zum Beispiel nur noch Vertreter aus einer von vier bekannten Enzym-Klassen. Ihre Vorläufer wirken hingegen nahezu wahllos gegen alle elf verschiedenen HDACs.
Wieder andere Kandidaten richten sich gegen epigenetische Enzyme, an denen noch gar kein zugelassenes Medikament ansetzt, etwa an Histondemethylasen, die Methylgruppen von Histonen entfernen oder an die so genannten Bromodomänen, die den Histon-Code „lesen“ und auf diesem Weg andere Enzyme gezielt an bestimmte epigenetisch markierte Stellen der DNA transportieren. Ein solcher Bromodomänen-Hemmer kam zum Beispiel in der bereits hier vorgestellten Studie mit Hepatitis-D-Viren zum Einsatz.
2021: Blinde Mäuse können dank epigenetischer Verjüngung wieder sehen
Was ein internationales Team um den Alterungsforscher David Sinclair, aus Harvard, USA, im Fachblatt Nature publizierte ist eine wissenschaftliche Sensation: „Wir zeigen hier, dass es möglich ist, ohne Nebenwirkungen das Alter eines komplexen Gewebes im lebenden Organismus zurückzusetzen und damit seine verloren gegangene biologische Funktion wiederherzustellen“, schreiben die Forscher*innen.
Andrew Huberman von der Stanford University sieht es im Begleitkommentar ähnlich: Auf einmal sei denkbar, erblindeten Menschen das Augenlicht zurück zu schenken sowie Zellen aller Art epigenetisch zu verjüngen. „Für Jahrzehnte hatte man auf neue Werkzeuge gehofft, mit denen sich das gealterte oder geschädigte Gehirn reparieren lässt“, schreibt der Neurobiologe. Die neue Studie zeige nun: „Wir sind in dieser Ära angekommen.“
Doch worum geht es genau? Die Forscher*innen verjüngten Zellen des Sehnervs alter blinder Mäuse und machten sie damit wieder sehend. Mit einem molekularbiologischen Trick programmierte Sinclairs Team die Umgebung der DNA in beschädigten, so genannten retinalen Ganglionzellen um. Die Epigenetik der Zellen war danach wie jene junger Zellen. So kehrte ihre Fähigkeit zurück, den Schaden aus eigener Kraft zu reparieren.
Das erfolgreiche Experiment – am vollständigen, komplexen Tier und nicht in irgendeinem Reagenzglas mit kultivierten Zellen durchgeführt – ist also eine Art Verjüngungskur für Seh-Zellen lebendiger Mäuse. Doch vielleicht ist es sogar sehr viel mehr? Es könnte den Weg bereiten zu einer allgemeingültigen Methode, die biologische Uhr höherer Lebewesen gezielt zurückzudrehen. Damit könnten Alterungsprozesse rückgängig gemacht werden. Vielleicht gelänge das Gleiche dann sogar beim Menschen? Und es funktionierte sogar in anderen Geweben und Organen?
Sinclair und Kolleg*innen benutzten harmlose Viren als Transporter, um die Gene dreier so genannter Yamanaka-Faktoren, Oct4, Sox2 und Klf4 ins Erbgut der verletzten Zellen einzuschleusen. Mit vieren dieser Faktoren hatte der Japaner Shinya Yamanaka einst Körperzellen von Mäusen zu Stammzellen zurückprogrammiert, wofür er im Jahr 2012 den Nobelpreis erhielt. Im aktuellen Experiment war die Umgebung der Gene so konstruiert, dass die Zellen diese immer nur dann ablesen konnten, wenn den Mäusen eine bestimmte Substanz in das Trinkwasser gegeben wurde. So konnten die Forscher*innen den Einsatz der Gene steuern und zeitlich exakt begrenzen.
Bei rund 40 Prozent der Zellen war das Verfahren erfolgreich. Diese änderten schon fünf Tage nachdem die eingeschleusten Gene angeschaltet blieben, das Muster, in dem viele andere ihrer Gene aktiv waren. Infolgedessen begannen sie, sich zu verjüngen. Mit fortschreitender Behandlungszeit wandelte sich ihre Epigenetik zurück, und sie starteten die Reparatur der Schäden. Weil die Gene aber immer nur kurzzeitig aktiv waren, gab es keine bösartigen Entartungen oder andere Nebenwirkungen. Die Zellen wurden nur ein Stück weit verjüngt. Sie wurden nicht reprogrammiert, sondern behielten ihre Identität.
Nebenbei liefert das Experiment auch einen deutlichen Hinweis, dass die so genannte epigenetische Uhr, über die im Newsletter Epigenetik schon häufig berichtet wurde (siehe u.a. Newsletter Epigenetik 32: Was epigenetische Uhren können), tatsächlich das Altern von Zellen zu kontrollieren scheint, und das man sie gezielt zurückdrehen kann.
2022: Rassezucht hat Persönlichkeit von Hunden kaum beeinflusst
Nur neun Prozent der rassetypischen Unterschiede im Verhalten von Hunden sind laut einer im Fachblatt Science veröffentlichten Studie auf deren Gene zurückzuführen. Das Wesen eines Hundes scheint zu komplex, um schon nach 200 Jahren Rassezucht deutlich beeinflusst worden zu sein. Vermutlich spielen epigenetische Mechanismen sowie die perinatale Prägung (Erfahrungen aus der Zeit im Muttertier und den ersten Lebensmonaten) beim Verhalten von Hunden eine größere Rolle als bisher gedacht.

Ein Team um die Bioinformatikerin Elinor Karlsson von der University of Massachusetts, USA, nutzte zahlreichen Daten für eine so genannte Genomweite Assoziationsstudie (GWAS). Sie ermittelten Korrelationen zwischen bestimmten Genvarianten und rassetypischen Verhaltensweisen. Doch erstaunlicherweise wurden sie kaum fündig. „Die meisten Verhaltensweisen, die wir als Merkmale bestimmter moderner Hunderassen ansehen, sind höchstwahrscheinlich im Laufe der Jahrtausende währenden Evolution vom Wolf über den Wildhund zum Haushund und schließlich zu den modernen Hunderassen entstanden“, sagt Karlsson. Das heißt aber auch: „Diese vererbbaren Merkmale liegen Tausende von Jahren vor unserem Konzept der modernen Hunderassen.“
Zwar fanden sich elf Gene, deren Varianten relativ eng mit dem Verhalten der Hunde assoziiert waren. Keines davon ließ sich aber einer bestimmten Rasse zuordnen. Am besten kann man das Verhalten eines Hundes vorhersagen, wenn man sein Alter und sein Geschlecht kennt – völlig unabhängig von der Rasse. Bestätigen sich diese neuen wissenschaftlichen Erkenntnisse, sollten Zuchtverbände den Wesenstest für die Hundezucht überdenken und vermehrt die Zuchtbedingungen ins Visier nehmen.
2023: In eigener Sache: Die Zukunft des Newsletter Epigenetik
www.riffreporter.de/de/wissen/erbe-umwelt-news-newsletter-riffreporter-magazin
„Faszination Wissenschaft – kompetent, hintergründig und verständlich erklärt“: So lautet der Anspruch des persönlichen Newsletters von Peter Spork, Sporks Science News(früher Erbe&Umwelt-News). Sein Publikum soll Wissenschaft besser verstehen und in wichtigen Forschungsgebieten unserer Zeit wie Schlaf und Chronobiologie, Gesundheit, Anti-Aging, Epigenetik, Genetik oder Systembiologie auf dem Laufenden bleiben.
Peter Spork gilt als „der Mann, der die Epigenetik populär machte“ (DLF). Er „besitzt die seltene Gabe, hochkomplexe Themen allgemeinverständlich zu erklären“ (Saarbrücker Zeitung). Mit seinen Büchern und Vorträgen, aber auch mit dem hier vorliegenden Newsletter Epigenetik hat er das hoffentlich immer wieder bestätigt. Sporks Science News ist kostenlos und erscheint freitags alle 14 Tage. Sie enthält eine Rubrik namens Epigenetik-News, in der stets ein oder zwei Meldungen erscheinen, die Spork kurz zuvor für die Internetpräsenz www.newsletter-epigenetik.de geschrieben hat.

Der Newsletter Epigenetik in seiner jetzigen Form als ein bis vier Mal pro Jahr erscheinendes PDF-Magazin wird damit überflüssig. Das neue Angebot garantiert, dass die Meldungen zur Epigenetik sehr viel schneller und aktueller bei Ihnen, liebe Leser*innen, ankommen. Der E-Mail-Verteiler zum Versand des Newsletter Epigenetik wird deshalb in wenigen Wochen vollständig gelöscht. Alle Leser*innen werden gebeten, sich auf der Anmelde- und Info-Seite der Sporks Science Newsneu anzumelden. Dort finden Sie auch Links zu allen bisher erschienenen Ausgaben.
Die Internetpräsenz www.newsletter-epigenetik.de bleibt erhalten, sie wird aktuell allerdings überarbeitet und ist deshalb nur eingeschränkt funktionsfähig. Sie kann weiterhin als Datenbank mit mehr als 850 Meldungen aus mehr als 13 Jahren genutzt werden und wird von nun an dank des neuen Konzepts alle 14 Tage weiter wachsen.
Eine Möglichkeit zum Herunterladen sämtlicher 37 Ausgaben desNewsletter Epigenetikfinden Sie hier.