Covid-19: Fehlgeleitete Immunantwort auf das Coronavirus kann das Gehirn schädigen
US-ForscherInnen sehen Ursache für akute neurologische Komplikationen und möglicherweise auch Long Covid in Störung der Blut-Hirn-Schranke und Absterben von Nervenzellen

US-amerikanische Forschende vom National Institute of Neurological Disorders and Stroke zeigen an Autopsie-Material von Corona-Toten, welche Folgen eine Infektion mit Sars-CoV-2 auf das Nervengewebe haben kann. Danach scheint weniger das Virus selbst, sondern eine fehlgeleitete Immunreaktion für das Absterben von Nervenzellen und die Bildung winziger Blutgerinnsel in den Mikrogefäßen des Gehirns verantwortlich zu sein. Warum die Studie wichtig ist und was das Ergebnis auch für die Behandlung und Prävention von Long Covid bedeuten könnte.
Warum die Studie wichtig ist
Schon bald nach Beginn der Pandemie war klar: Covid-19 ist nicht nur eine Erkrankung der Atemwege. Neben der Lunge können auch andere Organe durch die Corona-Infektion Schaden nehmen – etwa das Herz, die Blutgefäße, die Nieren, das Gehirn, die Leber. Das Virus selbst kann Gewebe zerstören, wenn es sich in Zellen vermehrt. Aber auch die Immunabwehr ist an den Schäden beteiligt, wenn es virusinfizierte Zellen angreift.
Bei einigen PatientInnen mit einer Corona-Infektion stellen sich neurologische Komplikationen ein. Das kann während der akuten Krankheitsphase oder auch später geschehen. Viele klagen über Konzentrationsschwierigkeiten, Schlafstörungen, Kopfschmerzen, Fatigue, sensorischen Problemen oder bekommen in zeitlicher Nähe zur Corona-Infektion gar einen Schlaganfall. Covid-19 kann möglicherweise das Risiko für eine Alzheimer-Demenz erhöhen beziehungsweise den Krankheitsverlauf beschleunigen.
Noch ist nicht klar, wie das Virus die Nervenzellen schädigt und wodurch genau die neurologischen Symptome ausgelöst werden. Um Strategien für die Therapie oder Prävention zu entwickeln, ist es unbedingt nötig, die Krankheitsprozesse besser zu verstehen.
Was die ForscherInnnen gemacht haben
Avindra Nath ist ein Neuroimmunologe, der sich schon seit Jahrzehnten mit den neurologischen Folgen von Virusinfektionen – besonders bei HIV/AIDS und der Influenza-Grippe – beschäftigt. Nath und sein Team vom National Institute of Neurological Disorders and Stroke im US-amerikanischen Bethesda, veröffentlichten vor gut eineinhalb Jahren ihre ersten Beobachtungen an PatientInnen, die während der ersten Corona-Welle an Covid-19 gestorben waren. Die Forschenden hatten das Gehirn der Verstorbenen mit dem MRT untersucht. Bei einigen von ihnen entdeckten sie verstreut über die untersuchten Hirnareale auffällige Gewebeverletzungen.
In der aktuellen Untersuchung versuchten die US-Amerikaner herauszufinden, wie es zu den Schädigungen kommen konnte. Dazu fertigten sie Gewebeschnitte von verschiedenen Regionen des Gehirns an. Mit speziellen Färbe- und anderen Nachweismethoden untersuchten sie das Gewebe auf die Anwesenheit von Immunzellen, Signalstoffen, winziger Blutgerinnsel und Sars-CoV-2.
Das Autopsie-Material stammte von zwei Frauen und sieben Männern, 24 bis 73 Jahre alt, die von März bis Juli 2020 an Covid-19 gestorben waren. Fünf von ihnen starben sehr plötzlich, nur einer war wegen einem schweren Krankheitsverlauf auf der Intensivstation behandelt worden.
Wie das Ergebnis der Studie aussieht
Obwohl die Verstorbenen das Virus zum Zeitpunkt ihres Todes in sich trugen, gelang in keiner der untersuchten Gehirn-Proben der Nachweis von Sars-CoV-2.
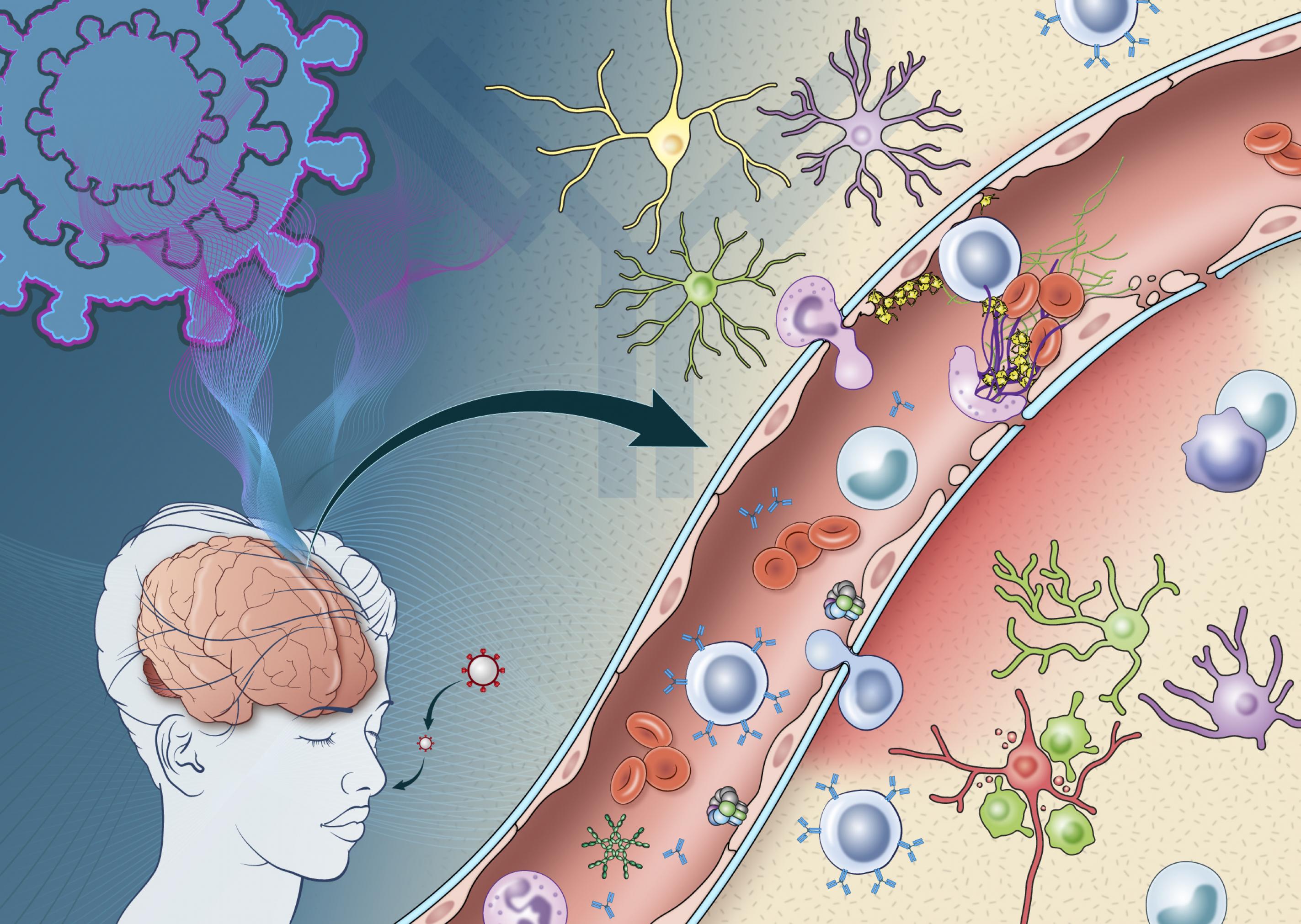
Bei allen Verstorbenen fand das Team um Avindra Nath jedoch deutliche Anzeichen für eine Zerstörung der schützenden Blut-Hirn-Schranke in den geschädigten Gehirnarealen. Das Protein Fibrinogen, das normalerweise im Blutserum zu finden ist, war in das Hirngewebe gesickert. Die Wandzellen, die die Mikrogefäße des Gehirns auskleiden, waren aktiviert, Immunkomplexe aus Antikörpern und Bestandteilen der „Komplementkaskade“ (einem Abwehrsystem, das die Beseitigung von Erregern unterstützt) hatten sich angelagert, Entzündungszellen waren eingewandert, einige der winzigen Gefäße durch Blutgerinnsel verschlossen. Im Umfeld dieser Entzündungsherde waren Nervenzellen abgestorben. Die meisten Läsionen entdeckte das US-Team im so genannten Hinterhirn, zu dem auch das Kleinhirn und der Hirnstamm gehören.
Die Forscherinnen und Forscher vermuten, dass Antikörper gegen das Virus oder Autoimmun-Antikörper die Immunkaskade ausgelöst und den Schaden verursacht haben.
Welche Schwächen die Studie hat
Trotz verschiedener technischer Bemühungen gelang es den ForscherInnen nicht, das Coronavirus im Hirngewebe nachzuweisen. Das muss nicht zwingend heißen, dass das Virus nicht zu einem bestimmten Zeitpunkt, den die Studie nicht erfasst, im Gehirn anwesend war. Den negativen Befund können etwa äußerst geringe Virusmengen unterhalb der Nachweisgrenze oder methodische Fehler verursacht haben. Weil die meisten Betroffenen tot aufgefunden wurden, standen nur ungenügende Daten zur medizinischen Vorgeschichte beziehungsweise zum Verlauf der Covid-19-Erkrankung zur Verfügung.
Die Wahrscheinlichkeit, dass das Virus und die ausgelöste Immunreaktion für die Schädigungen verantwortlich sind, ist extrem hoch. Dennoch könne nicht völlig ausgeschlossen werden, dass die Verletzung der Blut-Hirn-Schranke (mit Gerinnselbildung und Entzündung) nicht auch auf andere Ereignisse außerhalb der Corona-Infektion zurückzuführen sei, schränken Avindra Nath und seine KollegInnen ihre Ergebnisse ein.
Was das Ergebnis bedeutet
Eigentlich habe er wegen der Schäden im Hirngewebe erwartet, das Coronavirus an Ort und Stelle nachzuweisen, sagt Avindra Nath. Einige andere Studien zuvor hatten ebenfalls kein oder wenn nur extrem wenig Virusmaterial im Zentralen Nervensystem gefunden. Diese, wenn überhaupt nur geringen, Virusmengen reichten bei weitem nicht aus, um die beobachteten Effekte auf das Gehirn und die neurologischen Folgen zu erklären, so der Neuroimmunologe Nath gegenüber dem Magazin „Science“.
Möglicherweise sei es die Immunreaktion auf die Infektion gewesen, die den Tod der Betroffenen (mit) verursacht habe. Hätten die PatientInnen überlebt, hätten die ausgelösten Prozesse womöglich zu Long Covid geführt, mutmaßt Avindra Nath. Womöglich dauere diese Immunreaktion in gewissem Umfang bei Long-Covid-PatientInnen weiter an und verursache die Nervenschädigungen und neurologischen Beschwerden, sagt Nath. Therapien, die diese ungünstigen Ereignisse abschwächten, könnten den Betroffenen eventuell helfen. Man müsse verhindern, dass sich Immunkomplexe in den Blutgefäßen ablagerten, die zu den Turbulenzen führten.
Tatsächlich beginnt in den USA unter Federführung von Avindra Nath in diesen Wochen eine Studie, die testet, ob mit Medikamenten, die die Immunantwort hemmen, Long-Covid PatientInnen geholfen werden kann. Die ForscherInnen testen das Medikament Methylprednisolon, das Entzündungen hemmt sowie hochdosierte Immunglobulin-Präparate, die unter anderem bei bestimmten Autoimmunerkrankungen zum Einsatz kommen. Warum sie den Angriff auf körpereignes Gewebe, zum Beispiel bei der Multiplen Sklerose, abmildern können, weiß man noch nicht genau. Vermutlich hemmen die hochkonzentrierten Antikörper-Präparate die Produktion von Auto-Antikörpern und mildern die Ausschüttung von Entzündungsstoffen ab.
Worüber die Untersuchung keine Aussagen macht
Welches Antigen die fehlgeleitete Immunreaktion anstößt, ist noch unbekannt. Ebenso, warum manche Menschen neurologische Komplikationen bekommen und andere nicht. Möglicherweise haben sich Immunkomplexe aus Antikörpern und dem Spike-Protein des Virus gebildet. Diese lagerten sich an den ACE-2-Rezeptor auf der Gefäßwand an und lösten dadurch die Entzündungsprozesse aus. Oder im Zuge der Immunreaktion haben sich autoaggressive Antikörper gebildet, die nicht an das Spike-Protein des Coronavirus, sondern an sein „Gegenüber“, das ACE2-Protein auf den Gefäßwandzellen, binden. Ob ähnliche Mechanismen tatsächlich die Grundlage von Long Covid bilden, kann anhand dieser Studienergebnisse nur gemutmaßt werden. Denn Untersuchungen an Long-Covid-PatientInnen sind natürlich nicht so möglich, wie die hier besprochene Analyse von Autopsie-Material aus dem Gehirn von Verstorbenen.